توضیحات
پروژه متلب تشخیص کمپلکس QRS در سیگنال ECG با الگوریتم Pan Tompkins
معرفی و تفسیر سیگنال الکتروکاردیوگرافی (ECG):
سیگنال الکتروکاردیوگرام یا ECG نماد عینی فعالیت الکتریکی قلب است که به شکل تغییرات پتانسیل الکتریکی در سطح پوست منعکس می شود. سیگنال الکتروکاردیوگرام روی نوار ثبت گردیده و روی صفحه اسیلوسکوپ ظاهر میشود. در هنگام ثبت سیگنال الکتروکاردیوگرام باید به سن، جنس، فشار خون، قد، وزن، علایم و داروهای مصرفی(به ویژه دیژیتال و داروهای ضد آریتمی) اشاره شود تا تفسیر سیگنال الکتروکاردیوگرام با دقت بیشتری انجام گیرد.
انجام الكتروکاردیوگرافی به خصوص در وضعیت هایی مانند اختلالات سرعت یا ریتم ضربانات قلب، اختلالات هدایتی قلب، بزرگی حفرات قلب، وجود انفارکتوس میوکارد، و اختلالات تعادل الکترولیتی سودمند است. فعالیت الکتریکی قلب را می توان به کمک سیگنال الکتروکاردیوگرام مشاهده کرد. هر مرحله ای از فعالیت قلب به شکل موجی خاص منعکس می شود. دستگاه الکتروکاردیوگرافی این امواج را می گیرد و به شکل نوار قلب آنها را نشان می دهد. فعالیت الکتریکی قلب توسط اشتقاق ها یا الکترودهای مخصوص (ليدها) (lead) که روی نقاط مختلف و مشخص بدن قرار می گیرند دریافت می شود.
انواع ECG:
دو نوع ثبت کننده ECG شامل ECG دوازده لیدی و ECG تک لیدی وجود دارد. هر دو نوع، اطلاعات حائز اهمیتی را در ارتباط با فعالیت قلب ارائه می دهند. یک ECG دوازده لیدی، اطلاعاتی از دوازده نمای مختلف قلب را ثبت می کند و تصویر کاملی از فعالیت های الکتریکی را به نمایش می گذارد. با قرار دادن شش الکترود بر روی سینه و شش الکترود بر روی اندام های بیمار، می توان سیگنال خروجی از دوازده لید ECG را ثبت نمود.
شش لید اندام، یعنی لیدهایI، II، III وکتور تقویت شده دست راست (aVR)، وکتور تقویت شده دست چپ (aVL) و وکتور تقویت شده پای چپ (aVF)، اطلاعاتی در ارتباط با سطح فرونتال( قدامی) قلب بدست می دهند. برای ثبت لیدهایI، II، III یک الكترود منفی و یک الکترود مثبت لازم است، لیدهای فوق را لیدهای دو قطبی می نامند.
لیدهای تشدید شده (aVR، aVL، aVF) اطلاعات را از یک لید ثبت می کنند، بنابراین به عنوان لیدهای تک قطبی نامگذاری شده اند.
لیدهای شش گانه جلو سینه ای، شامل V1,V2, V3, V4, V5,V6 اطلاعاتی در ارتباط با سطح افقی قلب بدست می دهند. این لیدها، همانند لیدهای تشدید شده، تک قطبی هستند و فقط به یک الکترود نیاز دارند. قطب مخالف این لیدها در مرکز قلب قرار دارد و تغییرات پتانسیل توسط دستگاه الکتروکاردیوگرافی محاسبه می گردد.فیت سیگنال ECG با استفاده از تبدیل موجک و فیلترهای وفقی
ECG تک لیدی، اطلاعات پیوسته ای در ارتباط با فعالیت قلب را نمایش می دهد و برای مانیتورینگ مداوم وضعیت قلب مورد استفاده قرار می گیرد. الکترودهای سینه ای، فعالیت الکتریکی قلب را برای نمایش بر روی صفحه مانیتور انتقال می دهند. دستگاه مانیتور همچنین تعداد ضربان قلب و سایر موارد را نمایش می دهد و نوارهایی از ریتم قلب را بر روی کاغذ مخصوص رسم می کند.
لیدهای ثبت شده معمول(از نوع دوازده گانه)، شامل لیدهای اندامی و دو قطبی I، II، III و دو لید سینه ای و تک قطبی می باشند.
کاغذ الکتروکاردیوگرام:
امواج حاصل از جریان الکتریکی قلب بر روی کاغذ مخصوص شطرنجی ECG توسط یک سوزن حرارتی ترسیم می شود. کاغذ شطرنجی دارای یک محور افقی و یک محور عمودی است. یک قطعه از نوار ECG را یک استریپ ECG می نامند. محور افقی استریپ ECG زمان را نشان می دهد. هر مربع کوچک نماینده 0.04 ثانیه و ۵ مربع کوچک تشکیل یک مربع بزرگ را داده که نماینده 0.20 ثانیه از زمان است. محور عمودی استریپ ECG مربوط به سنجش دامنه یا ولتاژ الکتریکی بر حسب میلی ولت(mV) است. هر مربع کوچک نشان دهنده 0.5 میلی ولت است.
به منظور تعیین دامنه یک موج، قطعه یا فاصله، تعداد مربع های کوچک از خط پایه تا بالاترین یا پایین ترین نقطه موج، قطعه یا فاصله شمارش می گردد.
کمپلکس ECG:
کمپلکس ECG وقایع رخ داده در یک سیکل قطبی را نشان می دهد که از لید II گرفته شده است.
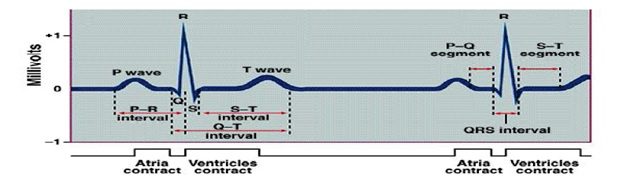
شکل ECG طبیعی.
یک کمپلکس شامل شش موج رده بندی شده P, Q, R, S, T, U است. سه حرف میانی(Q، R، S) مجموعاً یک کمپلکس QRS را تشکیل می دهند. ECG تنها هدایت الکتریکی از دهلیزها به طرف بطن ها را نشان می دهد.
موجP :
اولین موج در ECG طبیعی، موج P است که نشانه دپلاریزاسیون دهلیزی(هدایت یک ایمپالس الکتریکی در سراسر دهلیزها) می باشد. یک موج P طبیعی قبل از کمپلکس QRS قرار داشته، دارای ارتفاع ۲ تا ۳ میلی متر، مدت زمان 0.06 تا 0.12 ثانیه است. شکل موج P معمولاً مدور و رو به بالا می باشد.
اگر شکل و دفلکسیون (انحراف) یک موج P طبیعی باشد و به دنبال هر موج P یک کمپلکس QRS ظاهر شده باشد، میتوان مطمئن بود که منشأ ايمپالس های الکتریکی از گره سینوسی- دهلیزی(SA node) است. امواج P نوک تیز، دندانه دار یا پهن ممکن است نشان دهنده بزرگی یا هیپرتروفی دهلیزها بوده و امواج P معکوس، ممکن است دلالت بر صدور ایمپالس از کانون های مختلف داشته باشد. فقدان موج P مشخص، نشانه ای بر صدور ایمپالس از کانون های مختلف غیر از گره SA دارد.
فاصله PP
فاصله PR ( از ابتدای موج P تا ابتدای موج R) نشان دهنده ی زمان لازم برای عبور موج تحریک الکتریکی از دهلیزها تا الياف پورکنژ است. مدت زمان PR در بالغین به طور طبیعی بین 0.12 تا 0.20 ثانیه میباشد.
فاصله PR کوتاه نشان می دهد که ایمپالس الکتریکی از محلی غیر از گره SA سرچشمه می گیرد و فاصله های PR طولانی ممکن است نشان دهنده ی یک هدایت تأخیری در طول دهلیز یا اتصال دهلیزی – بطنی (AV ) به علت مسمومیت با دیژیتال یا بلوک قلبی باشند.
کمپلکس QRS :
کمپلکس QRS (از ابتدای موج Q تا انتهای موج S ) متعاقب موج P ظاهر می شود و بیانگر دپلاریزاسیون بطنی یا هدایت ایمپالس الکتریکی است. بلافاصله بعد از دپلاریزاسیون بطن ها، کمپلکس QRS تشکیل شده و بطن ها منقبض می شوند. حاصل انقباض، خروج خون از بطنها و پمپ آن به داخل شريان ها است و نتیجة آن ایجاد نبض است. کمپلکس QRS طبیعی پس از موج P قرار داشته و دارای ارتفاع ۵ تا ۳۰ میلی متر و مدت زمان 0.06 تا0.10 ثانیه است. شکل آن شامل موج Q (اولین دفلکسیون منفی یا بالاتر از خط پایه بعد از موج P ) موج R ( اولین دفلکسیون مثبت بعد از موج Q) و موج S (اولین دفلکسیون منفی بعد از موج R ) است.
عدم ظهور موج P به همراه کمپلکس QRS نشانه ای از سرچشمه گرفتن ایمپالس ها از بطن ها است و دلالت بر وجود یک آریتمی بطنی دارد. موجه ای Q عمیق و پهن می توانند نشانه انفارکتوس میوکارد باشند. موج R دندانه دار ممکن است بر بلوک شاخه ای دلالت کند. یک QRS پهن ( بیشتر از 0.12 ثانیه) می تواند نشانه ای از تأخیر در هدایت بطنی باشد. فقدان کمپلکس ORS ممکن است دلالت بر بلوک دهلیزی- بطنی داشته باشد.
قطعه ST:
قطعه ST بیانگر مرحله پایانی دپلاریزاسیون با هدایت بطنی و شروع رپلاریزاسیون یا استراحت بطنی است و از انتهای موج S تا ابتدای موج T امتداد دارد. تغییرات قطعه ST ممکن است بر صدمه میوکارد دلالت کند.
موج T:
موج T نشان دهنده مرحله استراحت یا رپلاریزاسیون بطنی است. موج T طبیعی، به دنبال موج S می باشد. دامنه آن در لید I, II, III، 0.5 میلی ولت و در لیدهای جلو سینه ای بالاتر از ۱۰ میلی ولت است. شکل آن نیز معمولاً صاف و مدور می باشد. مدت زمان در موج T اندازه گیری نمیشود. وجود برآمدگی هایی در موج T می تواند نشاندهنده ادغام شدن یک موج P در آن باشد. یک موج بلند و نوک تیز، می تواند نشان دهنده آسیب میوکارد یا افزایش پتاسیم باشد. معکوس شدن موج T در لیدهایI, II یا V3 تا V6 ممکن است نشان دهنده ایسکمی میوکارد باشد و امواج T به شدت نوک تیز یا دندانه دار در یک فرد بالغ می تواند دلالت بر وجود پریکاردیت (التهاب پریکارد) داشته باشد.
فاصله QT :
فاصله QT، مدت زمان دپلاریزاسیون و رپلاریزاسیون بطنی را اندازه گیری می کند. طول فاصله QT باتوجه به ضربان قلب می تواند متغیر باشد. فاصله QT طبیعی از زمان شروع کمپلکس QRS آغاز میشود و تا پایان موج T ادامه می یابد. مدت زمان آن اگر چه با توجه به سن، جنس و سرعت ضربان قلب متغیر است، ولی به طور معمول 0.36 تا 0.44 ثانیه طول می کشد. در عمل ارتفاع و شکل آن بررسی نمی شود. فواصل QT غیر طبیعی مشکلات میوکارد را تداعی می کند. افزایش فاصلة QT بر طولانی شدن رپلاریزاسیون بطنی دلالت میکند و کوتاه شدن آن ممکن است به علت مسمومیت با دیژیتال یا افزایش کلسیم باشد.
موج U :
موج U بیانگر دوره استراحت فیبرهای پورکنژ یا فیبرهای هدایتی بطنی است و در هر ریتم قلب خود را نشان نمیدهد. شکل موج U مهمترین خصوصیت قابل بررسی آن است. موج U به دنبال موج T قرار داشته و مدور و رو به بالا است. موج U غالب یا برجسته ممکن است به علت افزایش کلسیم، کاهش پتاسیم یا مسمومیت با دیژیتال ایجاد گردد.
آریتمی های قلبی:
بعضی از ناراحت کننده ترین انواع اختلال عمل قلب درنتیجه ریتم غیر طبیعی قلب به وجود میآیند. گاهی ریتم قلبی سریع تر یا آهسته تر از آن است که مقدار کافی خون را تلمبه بزند، گاهی فاصله بین ضربان های قلب کوتاه تر از آن است که بطن ها بتوانند از خون پر شوند، و گاهی ضربان دهلیزها کاملاً با ضربان بطن ها ناهمگام است به طوری که دهلیزها دیگر نمی توانند به عنوان پمپ های چاشنی برای بطن ها عمل کنند.
ریتم سینوسی نرمال:
قبل از تشخیص آریتمی لازم است ریتم سینوسی نرمال شناخته شود. ریتم سینوسی نرمال ترسیمی از یک ایمپالس ایجاد شده در گره سینوسی و پیشروی آن از طریق راه های هدایتی طبیعی به بطن ها است. ریتم سینوسی نرمال، یک ریتم استاندارد جهت مقایسه با سایر ریتم ها است. ریتم سینوسی نرمال دارای تعداد ضربان طبیعی بوده امواج P در آن مدور و صاف فاصله PR طبیعی و مدت زمان کمپلکس QRS طبیعی میباشد و هیچگونه ضربان نابجا یا غیرطبیعی در آن مشاهده نمیشود.
بلوک شاخه ای:
بلوک شاخه ای یکی از عوارض بالقوه انفارکتوس میوکارد است. بلوک شاخه ای ممکن است به صورت اختلال در هدایت ایمپالس ها در شاخه راست یا چپ بروز نماید. در بلوک شاخه ای، ایمپالس پایین تر از ناحیة صدمه دیده(قسمتی از شاخه که تحت تأثير بلوک قرار نگرفته است) از یک سلول میوکارد به سلول دیگر به منظور دپلاریزه کردن بطن هدایت می یابد. طولانی شدن زمان دپلاریزاسیون بطنی، بدین معنی که مدت زمان کمپلکس QRS، که 0.06 تا 0.1 ثانیه است به بیش از 0.12 ثانیه تجاوز نماید، نمایانگر بلوک شاخه ای خواهد بود. بلوک شاخه ای به دو دسته بلوک شاخه ای راست و چپ تقسیم می شود.
بلوک شاخه ای راست (RBBB):
بلوک شاخهای راست درنتیجه بیماریهایی همانند انفارکتوس دیوارة قدامی میوکارد، بیماری شریان کرونری و آمبولی ریه(وجود لخته خون یا چربی(به ندرت) در یکی از شریان هایی که به بافت ریه ها خونرسانی می کنند) رخ می دهد. این بلوک همچنین ممکن است بدون وجود بیماری قلبی حاصل گردد. در این اختلال مدت زمان کمپلکس QRS بیشتر از 0.12 ثانیه میباشد دپلاریزاسیون سپتوم(دیوارة بین دو بطن) ليد V1 را تحت تاثير قرار نمی دهد، بنابراین اولین موج R کوچک در این لید ظاهر میگردد. پس از موج R، یک موج S که نشاندهنده دپلاریزاسیون بطن چپ است ظاهر میگردد و سپس یک موج R بلند (‘R) که نشان دهنده دپلاریزاسیون دیررس بطن راست است دیده میشود. موج T در این لید منفی است. این دفلکسیون را تغيير ثانویه موج T می نامند و فاقد اهمیت بالینی است.
بلوک شاخه ای چپ (LBBB):
یک بلوک شاخه ای چپ به طور معمول به علت تنگی آئورت، بیماری هیپرتانسیون قلبی، تغییرات دژنراتیو سیستم هدایتی و یا بیماری شریان کرونری عارض میگردد. هنگامی که این بلوک همراه با یک انفارکتوس دیواره قدامی میوکارد به وجود آید، معمولاً به عنوان نشانه ای از بلوک کامل قلبی تلقی می گردد، که نیازمند استفاده از ضربان ساز می باشد. در LBBB، کمپلکس ORS بیشتر از 0.12 ثانیه خواهد بود، زیرا که بطن ها به طور همزمان فعال نمی گردند.
با توجه به این که موج دپلاریزاسیون از بطن راست به بطن چپ انتشار می یابد، بنابراین در لید V1 یک موج S پهن و عمیق و یک موج T مثبت تشکیل می گردد. ممکن است قبل از موج S یک موج Qیا R اولیه کوچک ظاهر شود.
پیس ریتم:
آریتمی ها بیشتر توسط داروها درمان میشوند. در مواردی که داروها مؤثر نیستند می توان از درمان های مکانیکی خاص استفاده کرد که یکی از شایع ترین آنها ضربان سازها هستند. ضربان ساز نوعی دستگاه تحریکساز الکترونیکی است که برای کنترل سرعت ضربان قلب، امواج تحریک را به صورت تکراری به قلب وارد می کند. ضربان ساز مصنوعی زمانی شروع به کار می کند و فعالیت آن ادامه می یابد که ضربان سازهای طبیعی قلب از کار افتاده باشد. ضربان قلب تولید شده بوسیله این ضربان سازهای مصنوعی، پیس ریتم (pace rhythm) نامیده می شود. ضربان سازها عموماً زمانی به کار می روند که شخص دچار آریتمی باشد همچنین کاربرد ضربانساز برای درمان بلوک انفارکتوس میوکارد بسیار معمول است. عوارض ناشی از اختلال عمل ضربان ساز به شکل تغییر ناگهانی سرعت و ریتم ضربان قلب ظاهر می شوند و شدت این علائم بر اساس وابستگی شخص به ضربان ساز مشخص می گردد. این عوارض با آنالیز ECG تعیین می شود و شناخت آنها برای کنترل وضعیت قلب بیمارانی که از این دستگاه استفاده می کنند بسیار ضروری می باشد.
پایگاه داده های بیماری های قلبی:
MIT-BIH Arrhythmia Database
این پایگاه داده برای اولین بار در ۱۹۸۰ منتشر شد، که اولین سری از تست های استاندارد برای آشکارسازهای آریتمی است و اکنون در بیش از ۵۰۰ سایت تحقیقاتی جهت این امر و مطالعه دینامیک فعالیت قلبی بکار میرود. این پایگاه داده شامل ۴۸ ثبت ECG دو کاناله میباشد که از ۴۷ مورد مطالعاتی در لابراتور آریتمی BIH در سال های1975 تا 1979 بدست آمده است. 23 ثبت نیز بطور تصادفی از بین ۴۰۰۰ ثبت ECG 24 ساعته، از بین جمعیت متفاوتی از بیماران بستری در بیمارستان(60%) و خارج از بیمارستان(40%) در بیمارستان Boston Beth جمع آوری شده است و ۲۵ ثبت دیگر نیز از همان دسته با شباهت کمتری به ثبت های دیگر اما با آریتمی کلینیکی کافی که بخوبی در یک نمونه تصادفی مشهود است
ثبت ها با فرکانس sample/sec 360 دیجیتال گشته و با دقت Bbit-11 در محدوده mv 10 ذخیره شده است. دو یا چند کاردیولوژیست مستقیماً هر ثبت را علامت گذاری کرده اند و تفاوت در اظهار نظرها به بهترین روش رفع شده است. ۲۵ فایل داده از ۴۸ فایل داده این پایگاه در اختیار می باشد.
MIT-BIH ST Changes پایگاه داده
این پایگاه داده شامل ۲۸ ثبت است که از ۱۳ تا ۶۷ دقیقه طول دارند. بیشتر این داده ها در طی تست ورزش به دست آمده اند و این ثبت ها دارای فرورفتگی هایی در قطعه ST به صورت گذرا و در پاسخ به فعالیت ورزشی هستند و شامل ایسکمی هم می شوند. چهار ثبت از Holter ECG است و بلندشدن قطعه ST را نشان می دهد. ۱۰ فایل شامل یک سیگنال و بقیه شامل دو سیگنال ثبت شده هستند. سیگنال ها فرکانس نمونه برداری 360 هرتز دارند و تغییرات قطعه ST در این فایل ها علامت گذاری نشده، اما کیفیت بیت ها و سیگنال ها علامتگذاری شده است.
MIT Malignant Vetricular Arrhythmia پایگاه داده
این پایگاه داده شامل ۲۲ ثبت ECG ، ۳۵ دقیقه ای است که از ۱۶Holter ECG بررسی شده بدست آمده است. این فایل ها نسبت به تغییر ریتم علامت گذاری شده است و شامل ۸۹ اپیزود از تاکیکاردی بطنی و ۶۰ اپیزود از فلوتر بطنی و ۴۲ اپیزود فیبریلاسیون بطنی است. هر فایل شامل دو سیگنال است که هر یک با فرکانس نمونهبرداری ۲۵۰ هرتز بدست آمده است.
MIT-BIH Atrial Fibrillation/Flutter پایگاه داده
این پایگاه داده جهت آشکارسازی فیبریلاسیون دهلیزی یا فلوتر که فقط به اطلاعات زمانی وابسته اند مفید است. این پایگاه داده شامل ۲۵ ثبت ۱۰ ساعته ECG (Holter ECG از 25 مورد) است که شامل ۳۰۰ اپیزود از فیبریلاسیون دهلیزی و ۴۰ اپیزود از فلوتر است زیرا هر ۲۵۰ ساعت از ثبت حجم بزرگی داشته لذا یک ثبت به همراه علامت گذاری هر ۲۵ ثبت ارائه شده است. علامت گذاری های فقط تغییرات ریتم را نشان می دهند. بیتها بوسیله آشکارساز اتوماتیک QRS آشکارسازی شده است و بیت ها به عنوان نرمال علامت خورده اند و فاصله را می توان از این علامت گذاری ها و به عنوان ورودی به آشکارساز فیبریلاسیون دهلیزی و فلوتر استفاده کرد. امکان بروز خطا در علامت گذاری ها وجود داشته و لذا هم اکنون نیز مورد بازبینی قرار دارد.
MIT-BIH Supraventricular Arrhyhmia پایگاه داده
این پایگاه داده شامل ۷۸ ثبت ۳۰ دقیقه ای ECG است که از Holter ECG بدست آمده و شامل Supraventricular است. این آریتمی ها به وسیله روشی نمیه اتوماتیک و بدون بازبینی علامت گذاری شده است و لذا ممکنArhythmia است شامل خطا باشد. فرکانس نمونه برداری HZ ۱۲۰ است.
MIT-BIH Long-Term پایگاه داده
این پایگاه داده شامل ۷ ثبت طولانی و علامت گذاری شده ECG است که از ۱۴ تا ۲۴ ساعت طول دارند. این فایل ها ثبت کامل و از Holter ECG هستند که از هفت مورد اخذ شده اند. این ثبت ها به وسیله روشی نیمه اتوماتیک علامت گذاری شده و در دست بازبینی است لذا ممکن است علامت گذاری ها شامل خطا باشد. ۶ عدد از این ثبت ها شامل دو سیگنال در فایل و بقیه شامل سه سیگنال است. همه سیگنال ها با فرکانس نمونه برداری Hz 128 نمونه برداری شده اند. برای ثبت های بیش از یک ساعت به پایگاه داده MIT.BIH Atrial Fibrillation/Flutter Database برای ثبت های حدود دو ساعت به پایگاه داده ST-T Databaseمی توان مراجعه نمود.
MIT-BIH Normal Sinus Rhythm پایگاه داده
این پایگاه داده شامل ۱۸ ثبت ECG است که هریک در مدتی بین ۲۰ تا ۲۴ ساعت از بیمارانی که کاملاً نرمال بوده اند اخذ شده است. فایل های header برای این ثبت ها شامل سن و جنس هر یک از بیماران و زمان انجام ثبت است. این فایل ها شامل علامت گذاری های توسط ماشین است که بطور دستی تصحیح شده اما ممکن است در علامت گذاری ها هنوز هم خطایی وجود داشته باشد.
Euraopean ST-T پایگاه داده
این پایگاه داده برای الگوریتم های آنالیزکننده تغییرات قطعه ST و موج T مناسب است. این پایگاه شامل ۹۰ ثبت ECG از 79 مورد می باشد و موارد آن: 70 مرد 30 تا 84 ساله و 8 زن 55 تا 71 ساله می باشد. ایسکمی برای هر مورد قابل تشخیص است و هچنین حالاتی غیرطبیعی مانند جابجایی خط پایه در قطعهST که از شرایطی مانند hypertention یا ventricular dyskinesia و اثرات مصرف دارو سرچشمه می گیرد. این پایگاه شامل ۳۶۷ اپیزود از تغییرات قطعهST است و 401 اپیزود از تغییرات موج T که مدت آنها از 30 ثانیه تا چندین قطعه است و جابجایی نقطه پیک از میکروولت تا یک میلی ولت در آنها دارد. به علاوه ۱۱ اپیزود از شیفت محوری که باعث تغییر در قطع ST می شوند و ۱۰ اپیزود از شیفت محوری که باعث تغییر در موج T می شوند به صورت علامت گذاری شده موجود است.
گزارش های کلینیکی شامل پاتولوژی، داروهای مصرفی و میزان عدم تعادل الکترولیت به همراه اطلاعات تکنیکی در header file موجود می باشد. هر ثبت دو ساعت زمان و شامل دو سیگنال نمونه برداری شده با فرکانس ۲۵۰HZ و با دقت bit 12 بر روی یک محدوده ۲۰ میلی ولتی از ورودی است. header فايل ها همچنین شامل اطلاعاتی از سن و جنسیت بیمار است. دو کاردیولوژیست مستقلا ثبت ها را علامت گذاری نموده اند. ۴۸ عدد از ۹۰ ثبت اصلی به همراه علامت گذاری های مربوط به همه ثبتها در اختیار است.
پایگاه داده مورد استفاده در تحقیق
همانطور که توضیح داده شد چندین پایگاه داده های متفاوتی وجود دارد که هر کدام از این پایگاه داده ها، جهت تحقيق خاصی جمع آوری شده اند. در این تحقیق از داده های موجود در پایگاه داده استاندارد آریتمی MIT-BIH استفاده شده است. این پایگاه داده شامل ۴۸ ثبت ECG دو کاناله است که از ۴۷ مورد مطالعاتی در لابراتوار آریتمی BIH بین سال های ۱۹۷۵ تا ۱۹۷۹ بدست آمده است. ثبت ها با فرکانس ۳۶۰ نمونه بر ثانیه دیجیتال شده اند و با دقت ۱۱ بیت در رنج ۱۰میلی ولت ذخیره شده است. دو تا چهار متخصص قلب مستقلا هر ثبت را علامت گذاری کرده اند و تفاوت در اظهار نظرها به بهترین روش رفع شده است. هم اکنون ۲۵ فایل داده از ۴۸ فایل داده این پایگاه دردسترس است.
این پایگاه داده معروفترین پایگاه است که در بسیاری از تحقیقات مورد استفاده قرار گرفته است و به جرات می توان این پایگاه داده را معروفترین و عمومی ترین داده در مورد پردازش سیگنال های قلبی دانست. در شکل زیر نمونه ای از سیگنال های گرفته شده توسط الکتروکاردیوگرام ، نشان داده شده است.
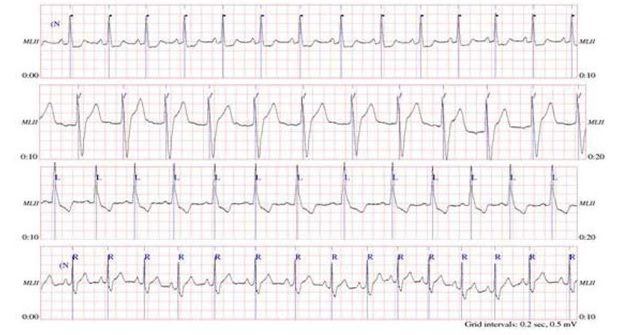
شکل نمونه ای از سیگنال های گرفته شده در چهار گروه افراد.
رﺳﺎﻧﺶ اﻟﻜﺘﺮﻳﻜﻲ در ﻗﻠﺐ
ﻳﻚ اﻟﻜﺘﺮوﻛﺎردﻳﻮﮔﺮاف، ﻛﻪ ﺑﻨﺎم ECG ﺷﻨﺎﺧﺘﻪ ﻣﻲ ﺷﻮد، اﺑﺰاري اﺳﺖ ﻛﻪ ﻓﻌﺎﻟﻴﺖ اﻟﻜﺘﺮﻳﻜﻲ ﻗﻠﺐ را ﺛﺒﺖ ﻣﻲ ﻛﻨﺪ. ECG ﺑﻪ ﻋﻨﻮان اﺳﺘﺎﻧﺪارد ﺟﻬﺎﻧﻲ ﺑﺮاي ﺗﺸﺨﻴﺺ آرﻳﺘﻤﻲ و دﻳﮕﺮ ﺑﻴﻤﺎريﻫﺎي ﻣﺮﺑﻮط ﺑﻪ ﻗﻠﺐ در ﻧﻈﺮ ﮔﺮﻓﺘﻪ ﺷﺪه اﺳﺖ. ﻣﺎﻫﻴﭽﻪﻫﺎي ﻗﻠﺒﻲ ﺷﺎﻣﻞ ٣٠٠ ﺗﺮﻳﻠﻴﻮن ﺳﻠﻮل ﻣﻲ ﺑﺎﺷﺪ، ﻛﻪ در ﺣﺎﻟﺖ اﺳﺘﺮاﺣﺖ ﺑﻪ ﺻﻮرت اﻟﻜﺘﺮﻳﻜﻲ ﺷﺎرژ ﻣﻲﺷﻮﻧﺪ، ﻛﻪ در ﺷﻜﻞ زیر ﻧﺸﺎن داده ﺷﺪه اﺳﺖ.
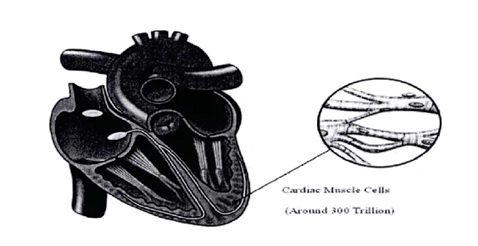
ﺷﻜﻞ-ﻣﺎﻫﻴﭽﻪ ﻫﺎي ﻗﻠﺒﻲ و ﺳﻠﻮل ﻫﺎي ﻋﺼﺒﻲ.
ﺳﻠﻮلﻫﺎي ﻣﺎﻫﻴﭽﻪﻫﺎي ﻗﻠﺒﻲ ﻧﺴﺒﺖ ﺑﻪ ﺑﻴﺮون داراي ﺑﺎرﻣﻨﻔﻲ ﻣﻲ ﺷﻮﻧﺪ اﻳﻦ ﺣﺎﻟﺖ، ﭘﺘﺎﻧﺴﻴﻞ اﻳﺴﺘﺎي ﺳﻠﻮلﻫﺎ ﻧﺎﻣﻴﺪه ﻣﻲﺷﻮد. وﻗﺘﻲ اﻳﻦ ﺳﻠﻮلﻫﺎ ﺑﻪ ﺻﻮرت اﻟﻜﺘﺮﻳﻜﻲ ﺑﺮاﻧﮕﻴﺨﺘﻪ ﻣﻲ ﺷﻮﻧﺪ، ﻏﻴﺮ ﻗﻄﺒﻴﺪه ﺧﻮاﻫﻨﺪ ﺷﺪ (ﭘﺘﺎﻧﺴﻴﻞ اﻳﺴﺘﺎي آﻧﻬﺎ از ﺣﺎﻟﺖ ﻣﻨﻔﻲ ﺑﻪ ﻣﺜﺒﺖ ﺗﻐﻴﺮ ﭘﻴﺪا ﻣﻲﻛﻨﺪ) و ﻣﻘﻴﺪ ﻣﻲ ﺷﻮﻧﺪ. ﭘﺎﻟﺲﻫﺎي ﻣﻨﺘﺸﺮ ﺷﺪه از ﻧﻘﺎط ﻣﺨﺘﻠﻒ در ﻗﻠﺐ، ﻣﻴﺪانﻫﺎي اﻟﻜﺘﺮﻳﻜﻲ را ﺑﻪ ﺻﻮرت ﻣﺪاوم از ﻟﺤﺎظ اﻧﺪازه و ﺟﻬﺖ ﺗﻐﻴﻴﺮ ﺧﻮاﻫﻨﺪ داد ﻛﻪ در ﺷﻜﻞ زیر ﺑﻪ ﺻﻮرت ﻛﺎﻣﻞ ﻧﺸﺎن داده ﺷﺪه اﺳﺖ.
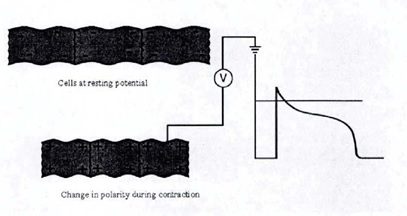
ﺷﻜﻞ ﺳﻠﻮل ﻗﻠﺒﻲ دﭘﻼرﻳﺰاﺳﻴﻮن.
ECG ﮔﺮاﻓﻴﻜﻲ از ﻣﻴﺎﻧﮕﻴﻦ ﻣﻴﻠﻴﺎردﻫﺎ ﺳﻴﮕﻨﺎل اﻟﻜﺘﺮﻳﻜﻲ ﻣﻴﻜﺮوﺳﻜﭙﻲ داﺧﻞ ﻗﻠﺐ ﺛﺒﺖ ﻣﻲﺷﻮد.
ﭘﺘﺎﻧﺴﻴﻞ ﻋﻤﻞ ﻗﻠﺐ:
ﺑﺮاي ﺳﻠﻮلﻫﺎي ﻋﺼﺒﻲ و ﻣﺎﻫﻴﭽﻪاي درﺑﺪن، وﻟﺘﺎژ ﻏﺸﺎي آﻧﻬﺎ ﺑﻪ ﻃﻮرﻋﻤﺪه در ﺑﻴﻦ ٩٠- ﺗﺎ ٦٠- ﻣﻴﻠﻲ وﻟﺖ ﻣﻲﺑﺎﺷﺪ، ﻛﻪ داﺧﻞ ﺳﻠﻮلﻫﺎ ﻧﺴﺒﺖ ﺑﻪ ﺑﻴﺮون آﻧﻬﺎ ﻣﻨﻔﻲﺗﺮ ﻣﻲﺑﺎﺷﺪ. ﻻﻳﻪ ﻣﻴﺎﻧﻲ ﺑﻴﻦ ﺑﻴﺮون و داﺧﻞ ﺳﻠﻮلﻫﺎ ﺗﺎ ﺣﺪ زﻳﺎدي از آﺑﻲ ﻛﻪ ﺷﺎﻣﻞ ﻳﻮنﻫﺎي ﻣﺨﺘﻠﻔﻲ ﻣﻲﺑﺎﺷﺪ ﺗﺸﻜﻴﻞ ﺷﺪه اﺳﺖ. ﻳﻮنﻫﺎﻳﻲ ﻛﻪ در ﭘﺎﺳﺦ ﺑﻪ واﻛﻨﺶ اﻟﻜﺘﺮﻳﻜﻲ، ﺣﺎﺻﻞ ﻣﻲﺷﻮد ﺳﺪﻳﻢ و ﭘﺘﺎﺳﻴﻢ ﻫﺴﺘﻨﺪ، na+ و . k+ ﺗﻤﺮﻛﺰ اﻳﻦ ﻳﻮنﻫﺎ در داﺧﻞ و ﺧﺎرج ﺳﻠﻮل ﺑﺎﻋﺚ اﻳﺠﺎد ﻧﻴﺮوي اﻟﻜﺘﺮوﻣﻜﺎﻧﻴﻜﻲ در ﻃﻮل ﻓﺸﺎري ﻛﻪ ﻳﻚ وﻟﺘﺎژ اﻟﻜﺘﺮﻳﻜﻲ ﺑﻪ ﺳﻠﻮل ﺗﺤﻤﻴﻞ ﺧﻮاﻫﺪ ﻛﺮد، ﻣﻲﺷﻮد.
درﺣﺎﻟﺖ اﺳﺘﺮاﺣﺖ، ﻏﻠﻈﺖ ﻳﻮﻧ ﻬﺎي na+ در ﺑﻴﺮون ﻏﺸﺎي ﺳﻠﻮﻟﻲ ﺑﻴﺸﺘﺮ از داﺧﻞ آن ﻣﻲ ﺑﺎﺷﺪ. ﺑﺮﻋﻜﺲ، ﻏﻠﻈﺖ k+ در داﺧﻞ ﺳﻠﻮل ﺑﻴﺸﺘﺮ از ﺧﺎرج آن ﻣﻲ ﺑﺎﺷﺪ. وﻟﺘﺎژ ﻣﺘﻌﺎدل وﻟﺘﺎژي اﺳﺖ ﻛﻪ در آن ﻏﻠﻈﺖ در ﻃﻮل ﻏﺸﺎ ﺑﺮاي ﻳﻮنﻫﺎي ﻛﻪ ﮔﻔﺘﻪ ﺷﺪ، در ﻳﻚ ﺣﺎﻟﺖ ﻣﺘﻌﺎدل ﻗﺮار دارد. ﺑﻪ ﻋﺒﺎرت دﻳﮕﺮ، وﻟﺘﺎژ در ﻃﻮل ﻏﺸﺎ ﺑﻪ ﻃﻮر ﻛﺎﻣﻞ ﺑﺎ ﺳﺎﻃﻊ ﺷﺪن ﻳﻮنﻫﺎ در ﻃﻮل ﺳﻠﻮل ﻣﻄﺎﺑﻘﺖ دارد درﺳﺖ ﺷﺒﻴﻪ ﺣﺎﻟﺘﻲ ﻛﻪ ﺟﺮﻳﺎن در ﻃﻮل ﻏﺸﺎ ﺻﻔﺮ ﺑﺎﺷﺪ. اﻳﻦ ﻋﻤﻞ اﻧﺘﻘﺎل از ﻳﻮنﻫﺎيna+ وk+ در داﺧﻞ و ﺑﻴﺮون ﺳﻠﻮل از ﻃﺮﻳﻖ ﺗﻌﺪادي از ﭘﺘﺎﺳﻴﻢﻫﺎ و ﺳﺪﻳﻢﻫﺎﻳﻲ ﻛﻪ در ﻃﻮل ﻏﺸﺎ ﺑﻪ ﺻﻮرت ﭘﺮاﻛﻨﺪه ارﺳﺎل ﺷﺪه اﻧﺪ، اﺗﻔﺎق ﻣﻲاﻓﺘﺪ.
در اﻳﻦ ارﺳﺎل دو ﻳﻮن از k+ از داﺧﻞ ﺳﻠﻮل ﺑﻪ ازاي ﺳﻪ ﻳﻮن na+ از ﺑﻴﺮون ﺳﻠﻮل اﻧﺘﻘﺎل ﻣﻲ ﻳﺎﺑﺪ. ﺑﻨﺎﺑﺮاﻳﻦ، ﻏﻠﻈﺖna+ در ﺑﻴﺮون ﺳﻠﻮل اﻓﺰاﻳﺶ ﻣﻲﻳﺎﺑﺪ و ﻏﻠﻈﺖ k+ در داﺧﻞ زﻳﺎد ﻣﻲ ﺷﻮد. در داﺧﻞ ﻏﺸﺎي ﺳﻠﻮلﻫﺎ، در ﺣﺎﻟﺖ اﺳﺘﺮاﺣﺖ ﻗﺪرت ﻧﻔﻮذﭘﺬﻳﺮي k+، ٧٥ ﺑﺮاﺑﺮ ﺑﻴﺸﺘﺮ اﺳﺖ ﻧﺴﺒﺖ ﺑﻪmv) na+٦٠Ena+ = + وEk+ =-80 mv).
اﻧﺮژي ﻛﻪ اﻳﻦ ﺗﻌﺎدل وﻟﺘﺎژي ﻧﮕﻪ ﻣﻲ دارد، از ﭘﺮوﺳﻪي ﺗﻐﻴﻴﺮ و ﺗﺤﻮل ﺳﻠﻮلﻫﺎي زﻧﺪه ﻧﺎﺷﻲ ﻣﻲ ﺷﻮد، ﺟﺎﻳﻲ ﻛﻪ ﺳﻠﻮل، اﻛﺴﻴﮋن ﻣﺼﺮف ﻣﻲ ﻛﻨﺪ و دي اﻛﺴﻴﺪ ﻛﺮﺑﻦ و ﮔﺮﻣﺎ ﺗﻮﻟﻴﺪ ﻣﻲ ﻛﻨﺪ. ﭘﺎﻟﺲ اﻟﻜﺘﺮﻳﻜﻲ اﻋﻤﺎل ﺷﺪه ﺑﺮ ﺳﻠﻮلﻫﺎﻳﻲ ﻛﻪ در ﻗﺴﻤﺖ ﻗﺒﻞ ﻣﻮرد ﺑﺤﺚ ﻗﺮار داده ﺷﺪه، ﻳﻚ ﺳﺮي ﻓﻌﻞ و اﻧﻔﻌﺎل را آﻏﺎز ﻣﻲﻛﻨﺪ ﻛﻪ ﺑﺎﻋﺚ اﻧﺘﺸﺎر ﻳﻚ وﻟﺘﺎژ ﻋﻤﻠﻲ ﻣﻲ ﺷﻮد. وﻟﺘﺎژ ﻋﻤﻠﻲ ﻳﻚ ﺗﻐﻴﻴﺮ اﻧﺘﺸﺎر در رﺳﺎﻧﺶ و وﻟﺘﺎژ، در ﻃﻮل ﻏﺸﺎي ﺳﻠﻮﻟﻲ ﻣﻲ ﺑﺎﺷﺪ و ﺑﻪ ﺻﻮرت ﺿﺮوري ﺷﺎﻣﻞ ﻳﻚ دﭘﻼرﻳﺰاﺳﻴﻮن و ﺑﻪ دﻧﺒﺎل آن رﭘﻼز اﻳﺴﻴﻮن اﺳﺖ (ﺟﺎﻳﻲ ﻛﻪ ﻏﺸﺎ ﺑﻪ ﺣﺎﻟﺖ وﻟﺘﺎژ ﺳﻜﻮن ﺧﻮد ﺑﺎز ﻣﻲﮔﺮدد).
ﭘﺮوﺳﻪ ﻛﺎﻣﻞ اﻳﻦ ﻋﻤﻞ را ﻣﻲ ﺗﻮان در ٥ ﻣﺮﺣﻠﻪ ﺗﻮﺿﻴﺢ داد، ﻛﻪ ﺑﺎ ﺷﻤﺎرهﻫﺎي ٠-٤ در شکل زیر ﺑﻪ ﻃﻮر ﻛﺎﻣﻞ ﻧﺸﺎن داده ﺷﺪ و در زﻳﺮ ﺑﻪ ﻃﻮر ﻛﺎﻣﻞ ﺗﻮﺿﻴﺢ ﻣﻲدﻫﻴﻢ:
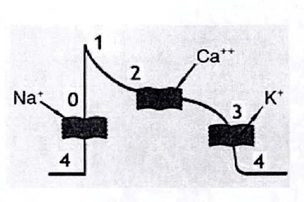
ﺷﻜﻞ منحنی دﭘﻼرﻳﺰاﺳﻴﻮن-رﻳﭙﻼرﻳﺰاﺳﻴﻮن ﻗﻠﺒﻲ.
ﻣﺮﺣﻠﻪ ٤: اﻳﻦ ﻣﺮﺣﻠﻪ ﻣﻄﺎﺑﻖ ﺑﺎ ﺣﺎﻟﺖ وﻟﺘﺎژ ﺳﻜﻮن ﻏﺸﺎ ﻣﻲﺑﺎﺷﺪ. ﺣﺎﻟﺘﻲ ﻛﻪ ﺳﻠﻮلﻫﺎ در آن ﻗﺮار دارﻧﺪ، ﺛﺎﺑﺖ ﻣﻲﻣﺎﻧﺪ ﻣﮕﺮ آﻧﻜﻪ ﺑﻪ وﺳﻴﻠﻪي ﻳﻚ ﺗﺤﺮﻳﻚ اﻟﻜﺘﺮﻳﻜﻲ ﺧﺎرﺟﻲ ﺑﺮاﻧﮕﻴﺨﺘﻪ ﺷﻮﻧﺪ(از ﻃﺮﻳﻖ ﻳﻚ ﺳﻠﻮل ﻣﺠﺎور). ﺳﻠﻮلﻫﺎي ﻣﺮﻛﺰي ﺗﻮاﻧﺎﻳﻲ ﺗﺤﻤﻴﻞ ﻳﻚ ﻗﻄﺒﺶزداﻳﻲ ﺧﻮد ﺑﻪ ﺧﻮد ﺑﺪون ﺗﻮﻟﻴﺪ وﻟﺘﺎژ ﺳﻜﻮن از ﺳﻠﻮل ﻣﺠﺎور را دارﻧﺪ، اﻳﻦ ﭘﺪﻳﺪه ﻣﺎﻫﻴﭽﻪي ﻗﻠﺒﻲ ﺧﻮدﻛﺎر ﻧﺎﻣﻴﺪه ﻣﻴﺸﻮد و در sinoatrial node در ﻗﻠﺐ اﺗﻔﺎق ﻣﻲاﻓﺘﺪ.
ﻣﺮﺣﻠﻪ ٠ : ﻏﺸﺎ، ﻳﻚ دﭘﻼرﻳﺰﺳﻴﻮن ﺳﺮﻳﻊ را در ﺟﺎﻳﻲ ﻛﻪ دروازهﻫﺎي ﺳﺪﻳﻢ در ﻏﺸﺎي ﺳﻠﻮل ﺑﺎز ﺷﺪه اﺳﺖ ﺗﺤﻤﻴﻞ ﻣﻲﻛﻨﻨﺪ و ﻣﻨﺠﺮ ﺑﻪ ﻫﺠﻮم ﺳﺮﻳﻊ ﻳﻮنﻫﺎي ﺳﺪﻳﻢ در ﺳﻠﻮل ﻣﻲ ﺷﻮﻧﺪ، ﺷﻴﺐ ﻣﺮﺑﻮط ﺑﻪ اﻳﻦ ﻣﺮﺣﻠﻪ ﻣﻨﺠﺮ ﺑﻪ ﺣﺪاﻛﺜﺮ وﻟﺘﺎژي ﻛﻪ در ﻣﻨﺤﻨﻲ ﻧﺸﺎن داده ﺷﺪه اﺳﺖ، ﻣﻲﺷﻮد. ﺗﻮاﻧﺎﻳﻲ ﺳﻠﻮل ﺑﺮاي ﺑﺎزﻛﺮدن ﺳﺮﻳﻊ ﻛﺎﻧﺎلna+ ﺑﻪ وﻟﺘﺎژ ﻏﺸﺎ ﻟﺤﻈﻪاﻳﻲ ﻛﻪ در ﺗﺤﺮﻳﻚ اﻋﻤﺎل ﻣﻲ ﺷﻮد، ﺑﺴﺘﮕﻲ دارد. اﮔﺮ وﻟﺘﺎژ ﻏﺸﺎ در ﺣﺪ ﭘﺎﻳﻴﻦ ﻧﮕﻪ داﺷﺘﻪ ﻣﻲﺷﺪ (ﺣﺪود ٨٥- ﻣﻴﻠﻲ وﻟﺖ) ﻫﻤﻪ ﻛﺎﻧﺎلﻫﺎ ﺑﻪ ﻃﻮر ﺟﺪاﮔﺎﻧﻪ ﺑﺴﺘﻪ ﻣﻲﺷﻮﻧﺪ و ﻫﻨﮕﺎﻣﻲ ﻛﻪ ﺗﺤﺮﻳﻚ اﻋﻤﺎل ﻣﻲ ﺷﺪ، ﺗﻤﺎم ﻛﺎﻧﺎلﻫﺎ ﺑﺎز ﺧﻮاﻫﻨﺪ ﺷﺪ ﺗﺎ ﻣﻨﺠﺮ ﺑﻪ وﻟﺘﺎژ ﺑﺎﻻﺗﺮ از وﻟﺘﺎژ ﻣﺎﻛﺰﻳﻤﻢ ﺷﻮد. ﺑﺎ اﻳﻦ ﺣﺎل، اﮔﺮ ﻏﺸﺎ در اﻧﺪازه ﺑﺎﻻﺗﺮ ﻧﮕﻪ داﺷﺘﻪ ﺷﻮد(ﺑﺎﻻﺗﺮ از ﻳﻚ ﻋﺪد ﺑﺰرگ)، ﻫﻤﻪ ﻛﺎﻧﺎلﻫﺎ na+ ﺑﺎز ﻧﺨﻮاﻫﻨﺪ ﺷﺪ و ﻳﻚ ﻣﻘﺪار ﭘﺎﻳﻴﻦﺗﺮ از ﻣﻘﺪار وﻟﺘﺎژ ﺣﺪاﻛﺜﺮ ﺑﻪ ﻣﺎ ﺧﻮاﻫﻨﺪ داد.
دﻟﻴﻞ اﻳﻦ ﻛﺎر اﻳﻦ اﺳﺖ ﻛﻪ، اﮔﺮ ﻏﺸﺎي ﺳﻠﻮﻟﻲ ﺑﻴﺶ از ﺣﺪ ﻣﺜﺒﺖ ﺑﺎﺷﺪ، اﻣﻜﺎن ﺗﺤﺮﻳﻚ ﺳﻠﻮل ﻣﻤﻜﻦ ﻧﻴﺴﺖ و ﻫﺪاﻳﺖ از ﻃﺮﻳﻖ ﻗﻠﺐ ﻣﻤﻜﻦ اﺳﺖ ﺗﺄﺧﻴﺮ داﺷﺘﻪ ﺑﺎﺷﺪ و ﺧﻄﺮ اﺑﺘﻼ ﺑﻪ ﺑﻴﻤﺎري آرﻳﺘﻤﻲ را اﻓﺰاﻳﺶ ﻣﻲدﻫﺪ. ﺑﺎﻳﺪ داﻧﺴﺖ ﻛﻪ ﻏﻠﻈﺖ ﻳﻮﻧﻬﺎيna+ وk+ درﻃﻮل ﻣﺮﺣﻠﻪ دﭘﻼرﻳﺰاﺳﻴﻮن زﻳﺎد ﺗﻐﻴﻴﺮ ﻧﻤﻲﻛﻨﺪ. در ﻋﻮض، ﻧﻔﻮذﭘﺬﻳﺮي ﺳﺪﻳﻢ اﻓﺰاﻳﺶ ﻣﻲﻳﺎﺑﺪ، ﻛﻪ وﻟﺘﺎژ ﻏﺸﺎي ﺳﻠﻮل را ﺑﻪ ﭘﺘﺎﻧﺴﻴﻞ ﺗﻌﺎدل ﺳﺪﻳﻢ ﻧﺰدﻳﻜﺘﺮ ﻣﻲ ﻛﻨﺪ (٥٥+ ﻣﻴﻠﻲ ولت).
ﻣﺮﺣﻠﻪ ١: ﺑﺎ ﻏﻴﺮ ﻓﻌﺎل ﻛﺮدن ﻛﺎﻧﺎلﻫﺎي ﺳﺪﻳﻢ، ﺑﻪ دﻧﺒﺎل آن، ﻓﻌﺎل ﺷﺪن ﭼﻨﺪ ﻛﺎﻧﺎل ﭘﺘﺎﺳﻴﻢ در ﻏﺸﺎي ﺳﻠﻮل ﺷﺮوع ﻣﻲﺷﻮد.ﻳﻚ ﻓﺮورﻓﺘﮕﻲ ﻣﺎﻧﻨﺪ آﻧﭽﻪ در ﺷﻜﻞ ﻣﻲﺑﻴﻨﻴﻢ ﺑﺎ ﺗﻮﺟﻪ ﺑﻪ ﺣﺮﻛﺖ ﺑﺮﺧﻲ از ﻳﻮنﻫﺎي ﭘﺘﺎﺳﻴﻢ در ﺧﺎرج از ﺳﻠﻮل ﺑﻪ وﺟﻮد ﻣﻲ آﻳﺪ. اﻳﻦ ﺗﻐﻴﻴﺮ وﻟﺘﺎژ ﻏﺸﺎ در ﺣﺠﻢ ﺑﺴﻴﺎر ﻛﻤﻲ اﺗﻔﺎق ﻣﻲاﻓﺘﺪ. ﺑﻪ اﻳﻦ ﻧﻜﺘﻪ ﺑﺎﻳﺴﺘﻲ ﺗﻮﺟﻪ ﻛﻨﻴﻢ ﻛﻪ اﻳﻦ روﻧﺪ ﺑﻪ دوﺑﺎره ﭘﻼرﻳﺰاﺳﻴﻮن ﻛﻤﻜﻲ ﻧﻤﻲ ﻛﻨﺪ.
ﻣﺮﺣﻠﻪ ٢: ﺑﻪ ﺻﻮرت ﻳﻚ ﺧﻂ اﻓﻘﻲ اﺳﺖ ﺑﻪ دﻟﻴﻞ اﻳﻦ واﻗﻌﻴﺖ ﻛﻪ ﺟﺮﻳﺎن ورودي و ﺧﺮوﺟﻲ ﻛﻪ در ﻛﺎﻧﺎل وﺟﻮد دارد ﺑﻪ ﺗﻌﺎدل رﺳﻴﺪه اﻧﺪ. اﻳﻦ ﺗﻌﺎدل ﺑﻪ ﻋﻠﺖ ﺟﺮﻳﺎن ﻳﻮن ﻛﻠﺴﻴﻢ در ﺳﻠﻮل اﻳﺠﺎد ﻣﻲ ﺷﻮد، ﻛﻪ ﺑﺮاي ﻣﺪت زﻣﺎن ﻛﻮﺗﺎه ﺑﻴﻦ ﻳﻮن k+ و na2+ ﭘﺎﻳﺪار اﺳﺖ ﺗﺎ زﻣﺎﻧﻲ ﻛﻪ دوﺑﺎره ﻗﻄﺒﻲ ﺷﺪﮔﻲ ﺷﺮوع ﺷﻮد.
ﻣﺮﺣﻠﻪ 3: ﻳﻚ ﻓﺎز رﭘﻼﻳﺰاﺳﻴﻮن را ﻧﺸﺎن ﻣﻲدﻫﺪ، ﻛﻪ در آن ﻛﺎﻧﺎلﻫﺎي ﻣﺮﺑﻮط ﺑﻪ ﻳﻮن ﻛﻠﺴﻴﻢ ﺑﺴﺘﻪ ﻫﺴﺘﻨﺪ ﺑﺎ اﻳﻦ ﺣﺎل ﻛﺎﻧﺎلﻫﺎي ﭘﺘﺎﺳﻴﻢ ﺑﺎز، ﺑﺎﻗﻲ ﻣﻲ ﻣﺎﻧﻨﺪ و ﺣﺮﻛﺖ ﻳﻮنﻫﺎ ﺑﻪ ﺧﺎرج ﺳﻠﻮل ﻫﻤﭽﻨﺎن وﺟﻮد دارد. اﻳﻦ ﻧﺘﺎﻳﺞ در ﺗﻐﻴﻴﺮ وﻟﺘﺎژ ﻏﺸﺎ ﺑﻪ ﺳﻤﺖ وﻟﺘﺎژ ﺗﻌﺎدل و اداﻣﻪي آن ﺗﺎ زﻣﺎﻧﻲ ﻛﻪ وﻟﺘﺎژ از ٨٠- ﺑﻪ ٨٥- ﻣﻴﻠﻲ وﻟﺖ ﺑﺮﺳﺪ ﻧﺸﺎﻧﻪاي از وﻟﺘﺎژ اﺳﺘﺮاﺣﺖ ﺳﻠﻮل ﻣﻲﺑﺎﺷﺪ. اﻳﻦ ﻛﺎﻧﺎلﻫﺎي ﭘﺘﺎﺳﻴﻢ ﻫﺴﺘﻨﺪ ﻛﻪ وﻟﺘﺎژ را ﻧﺰدﻳﻚ ﺑﻪ وﻟﺘﺎژي ﻛﻪ در ﺑﺎﻻ ﺑﻪ آن اﺷﺎره ﻛﺮدﻳﻢ ﻧﮕﻪ ﻣﻲ دارﻧﺪ و ﺳﻠﻮل ﻣﻨﺘﻈﺮ ﭼﺮﺧﻪ ﺑﻌﺪي ﺧﻮاﻫﺪ ﺷﺪ.
ﻫﺪاﻳﺖ اﻟﻜﺘﺮﻳﻜﻲ در ﻗﻠﺐ:
ﻧﻮد ﺳﻴﻨﻮﺳﻲ(SA) ﻛﻪ ﺗﻮﻟﻴﺪ ﺿﺮﺑﻪ (ﺿﺮﺑﺎن ﺳﺎز) ﻣﻲﻛﻨﺪ ﺑﺎﻓﺖ واﻗﻊ در دﻫﻠﻴﺰ ﺳﻤﺖ راﺳﺖ ﻣﻲﺑﺎﺷﺪ ﻛﻪ در ﺷﻜﻞ زﻳﺮ ﻣﺸﺎﻫﺪه ﻣﻲﻛﻨﻴﻢ. اﮔﺮﭼﻪ ﺗﻤﺎم ﺳﻠﻮلﻫﺎي ﻗﻠﺒﻲ ﺗﻮاﻧﺎﻳﻲ ﻻزم ﺑﺮاي ﺗﻮﻟﻴﺪ ﭘﺎﻟﺲ اﻟﻜﺘﺮﻳﻜﻲ ﻻزم ﺑﺮاي ﺿﺮﺑﺎن ﻗﻠﺒﻲ را دارا ﻣﻲ ﺑﺎﺷﻨﺪ، ﮔﺮه SA آﻏﺎز ﻛﻨﻨﺪه آن ﻣﻲ ﺑﺎﺷﺪ، زﻳﺮا ﭘﺎﻟﺲ ﻻزم ﺑﺮاي ﺗﭙﺶ ﻳﺎ ﺗﻮﻟﻴﺪ ﺿﺮﺑﺎن را ﺳﺮﻳﻌﺘﺮ از ﺳﺎﻳﺮ ﻧﻘﺎط ﺗﻮﻟﻴﺪ ﻣﻲﻛﻨﺪ. ﮔﺮه SA ﺑﻪ ﻃﻮر ﻃﺒﻴﻌﻲ ﺗﺨﻠﻴﻪ (دﺷﺎرژ) ﻣﻲﺷﻮد و ﭘﺘﺎﻧﺴﻴﻞ ﻋﻤﻞ را در ﺣﺪود ٦٠-١٠٠ ﺑﺎر در درﻗﻴﻘﻪ ﺑﻪ وﺟﻮد ﻣﻲآورد.
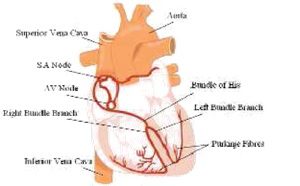
ﺷﻜﻞ ﻋﻨﺎﺻﺮ ﻣﺮﺑﻮط ﺑﻪ اﻧﺘﻘﺎل اﻟﻜﺘﺮﻳﻜﻲ ﻗﻠﺐ.
ﺳﻴﮕﻨﺎلﻫﺎي ﭘﺎﻟﺴﻲ ﻧﺎﺷﻲ از ﮔﺮه SA ﺑﺮاي اوﻟﻴﻦ واﻗﻄﺒﻴﺪﮔﻲ و اﻧﻘﺒﺎض دﻫﻠﻴﺰ ﺑﻪ وﺟﻮد ﻣﻲآﻳﺪ. اﻳﻦ ﺳﻴﮕﻨﺎلﻫﺎي الکتریکی ﺑﻪ ﺳﻤﺖ ﮔﺮه AV ﺣﺮﻛﺖ ﻣﻲ ﻛﻨﻨﺪ و ﺑﻌﺪ از ﻳﻚ ﺗﺄﺧﻴﺮ، ﺳﻴﮕﻨﺎل اﻟﻜﺘﺮﻳﻜﻲ از Av-node به bondle-His ﻣﻲ رﺳﻨﺪ و ﭘﺲ از آن ﺑﻪ ﺷﺎﺧﻪ ﭼﭗ و راﺳﺖ ﻛﻪ در ﻧﻬﺎﻳﺖ ﺑﻪ ﻳﻚ ﺷﺒﻜﻪ ﻣﺘﺮاﻛﻢ از ﻓﻴﺒﺮﻫﺎي ﭘﻮ رﻛﻨﺘﮋ ﺧﺘﻢ ﻣﻲﺷﻮﻧﺪ، ﻣﻲرﺳﻨﺪ. ﭘﻮرﻛﻨﺘﮋ، ﻓﻴﺒﺮﻫﺎي وﻳﮋهاﻳﻲ ﻫﺴﺘﻨﺪ ﻛﻪ در ﺑﻄﻦ دروﻧﻲ ﻗﻠﺐ وﺟﻮد دارﻧﺪ. اﻳﻦ ﭘﺎﻟﺲ اﻟﻜﺘﺮﻳﻜﻲ در ﻣﻨﻄﻘﻪ ﺑﻄﻦ ﺑﺎﻋﺚ اﻳﺠﺎد ﻳﻚ اﻧﻘﺒﺎض ﻫﻤﺎﻫﻨﮓ ﺧﻮاﻫﺪ ﺷﺪ. اﻳﻦ ﻓﺮآﻳﻨﺪ در ﻧﻬﺎﻳﺖ ﺗﻮﺳﻂ ECG ﺑﻪ ﻋﻨﻮان ﻳﻚ ﺷﻜﻞ ﻣﻮج ﺛﺒﺖ ﻣﻲ ﺷﻮد ﻛﻪ در ﺷﻜﻞ زیر دﻳﺪه ﻣﻲ ﺷﻮد.
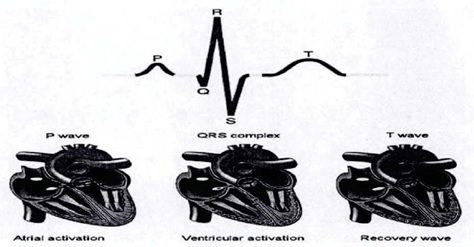
ﺷﻜﻞ ﻣﺮاﺣﻞ اﻧﺘﻘﺎل اﻟﻜﺘﺮﻳﻜﻲ و ﺗﻮﻟﻴﺪ ﻣﺠﻤﻮﻋﻪ QRS.
ﻣﻮج ECG در ﻃﻮل ﻫﺪاﻳﺖ اﻟﻜﺘﺮﻳﻜﻲ
ﺷﻜﻞ زﻳﺮ ﻧﻘﺎط ﻣﺨﺘﻠﻒ ﻣﻮج ECG را در ﻃﻮل ﻓﺮاﻳﻨﺪ ﻫﺪاﻳﺖ در ﻗﻠﺐ ﺑﻪ ﻃﻮر ﻛﺎﻣﻞ ﻧﺸﺎن ﻣﻲدﻫﺪ.
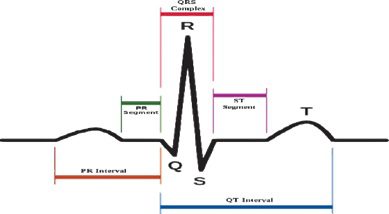
ﺷﻜﻞ ﻣﻮج ﻫﺎي P-Q-R-S-T و ﻓﻮاﺻﻞ آﻧﻬﺎ.
: SA node ﻣﻮج 😛 ﻳﻚ ﺗﺤﺮﻳﻚ اﻟﻜﺘﺮﻳﻜﻲ اﺳﺖ ﻛﻪ ﺧﻮد ﺑﻪ ﺧﻮد در ﻧﻮد SA ﺗﻮﻟﻴﺪ ﻣﻲﺷﻮد، اﻳﻦ ﭘﺎﻟﺲ اﻟﻜﺘﺮﻳﻜﻲ از ﻃﺮﻳﻖ دﻫﻠﻴﺰ راﺳﺖ ﻣﻨﺘﺸﺮ ﻣﻲﺷﻮد، ﺳﭙﺲ در دﻫﻠﻴﺰ ﭼﭗ ﺑﻪ واﺳﻄﻪ دﺳﺘﻪ Bachman و Fmally، ﺗﺤﺮﻳﻚ ﺳﻠﻮلﻫﺎي ﻋﺼﺒﻲ را در ﻣﻨﻄﻘﻪي دﻫﻠﻴﺰ اﻧﺠﺎم ﻣﻲدﻫﺪ.
اﻳﻦ اﻧﺘﻘﺎل ﭘﺎﻟﺲ اﻟﻜﺘﺮﻳﻜﻲ در ﺗﻤﺎم ﻣﻨﻄﻘﻪ دﻫﻠﻴﺰ در ﺳﻴﮕﻨﺎل ECG ﺑﻪ ﻋﻨﻮان ﻣﻮج P دﻳﺪه ﻣﻲﺷﻮد. راﺑﻄﻪ ﺑﻴﻦ ﻣﻮج P و ﻣﺠﻤﻮﻋﻪي QRS ﻛﻤﻚ ﻣﻲﻛﻨﺪ ﺗﺎ ﺗﻤﺎ ﻳﺰ ﺑﻴﻦ آرﻳﺘﻤﻲﻫﺎي ﻣﺨﺘﻠﻒ را ﺑﺪﺳﺖ آورﻳﻢ.
:AV node/B undles ﻓﺎﺻﻠﻪ : PR ﮔﺮه AV ﻳﻚ ﺗﺄﺧﻴﺮ ﻣﻬﻢ در ﺳﻴﺴﺘﻢ ﻫﺪاﻳﺖ اﻟﻜﺘﺮﻳﻜﻲ ﺑﻪ وﺟﻮد ﻣﻲآورد. ﺑﺪون اﻳﻦ ﺗﺄﺧﻴﺮ، دﻫﻠﻴﺰ و ﺑﻄﻦ در ﻳﻚ زﻣﺎن ﻣﻨﻘﺒﺾ ﻣﻲ ﺷﻮﻧﺪ و ﺧﻮن ﺑﻪ ﻃﻮر ﻣﺆﺛﺮ از دﻫﻠﻴﺰ ﺑﻪ ﺑﻄﻦ ﺟﺮﻳﺎن ﭘﻴﺪا ﻧﺨﻮاﻫﺪ ﻛﺮد. ﻓﺎﺻﻠﻪ PR از اﺑﺘﺪاي ﻣﻮج P ﺗﺎ ﺷﺮوع ﻣﺠﻤﻮﻋﻪ QRS ﻗﺎﺑﻞ اﻧﺪازهﮔﻴﺮي اﺳﺖ. و ﻣﻌﻤﻮﻻ در ﺣﺪود ١٠٠ ﺗﺎ ٢٠٠ ﻣﻴﻠﻲ ﺛﺎﻧﻴﻪ ﻃﻮل ﻣﻲﻛﺸﺪ. ﻃﻮل ﺑﺨﺶ PR در ﺗﺸﺨﻴﺺ ﻣﺴﺪود ﺷﺪن ﻗﻠﺐ ﺑﻴﻤﺎران ﻛﻤﻚ ﺧﻮاﻫﺪ ﻛﺮد.
اﻟﻴﺎف ﭘﻮرﻛﻨﺘﮋ/ﻋﻀﻠﻪ ﺑﻄﻨﻲ ﻗﻠﺐ: ﻣﺠﻤﻮﻋﻪ :QRS ﻣﺠﻤﻮﻋﻪ QRS ﻳﻚ ﺳﺎﺧﺘﺎر در ﻣﻮج ECG ﻣﻲﺑﺎﺷﺪ ﻛﻪ ﻣﺮﺑﻮط ﺑﻪ دﭘﻼرﻳﺰاﺳﻴﻮن ﺑﻄﻦ اﺳﺖ. ﺑﻄﻦ ﺷﺎﻣﻞ ﻋﻀﻼت ﺑﻴﺸﺘﺮي ﻧﺴﺒﺖ ﺑﻪ دﻫﻠﻴﺰ اﺳﺖ، ﺑﻪ ﻫﻤﻴﻦ ﺧﺎﻃﺮ ﻣﺠﻤﻮﻋﻪ QRS داراي داﻣﻨﻪ ﺑﺰرﮔﺘﺮي ﻧﺴﺒﺖ ﺑﻪ ﻣﻮج P ﻣﻲﺑﺎﺷﺪ. در ﻗﺴﻤﺖ آﺧﺮ ﮔﺮه AV دﺳﺘﻪ HIS وﺟﻮد دارد ﻛﻪ ﺑﻪ ﻧﻮﺑﻪي ﺧﻮد ﺑﻪ دو ﺷﺎﺧﻪي راﺳﺖ و ﭼﭗ ﺗﻘﺴﻴﻢ ﻣﻲ ﺷﻮﻧﺪ ﻛﻪ ﺑﻪ ﻗﺴﻤﺖﻫﺎي ﺑﻄﻦ راﺳﺖ و ﭼﭗ ﻣﺘﺼﻞ ﺷﺪهاﻧﺪ اﻳﻦ دو دﺳﺘﻪ از ﺷﺎﺧﻪﻫﺎ، در اﻧﺘﻬﺎ، ﺑﻪ ﺷﻜﻞ ﻓﻴﺒﺮﻫﺎي ﭘﻮرﻛﻨﺘﮋ ﺑﺎرﻳﻚ ﺷﺪهاﻧﺪ ﻛﻪ ﺗﺤﺮﻳﻚ ﺳﻠﻮلﻫﺎي ﻋﻀﻼﻧﻲ ﺑﻄﻦ ﻓﺮد را ﺑﻪ ﻋﻬﺪه دارﻧﺪ. دﺳﺘﻪﻫﺎي HIS دﭘﻼرﻳﺰاﺳﻴﻮن ﺑﻄﻦﻫﺎ را ﺑﻪ وﺳﻴﻠﻪ اﻓﺰاﻳﺶ ﺳﺮﻋﺖ ﻫﺪاﻳﺖ ﻫﻤﺎﻫﻨﮓ ﺧﻮاﻫﺪ ﻛﺮد از اﻳﻦ رو ﻣﺠﻤﻮﻋﻪ QRS ﺷﻜﻞ ﺷﺨﺼﻲ دارد. ﺑﻪ ﻃﻮر ﻣﻌﻤﻮل، ﻣﺪت زﻣﺎن QRS ﭼﻴﺰي در ﺣﺪود ٦٠ اﻟﻲ ١٠٠ ﻣﻴﻠﻲ ﺛﺎﻧﻴﻪ ﻣﻲ ﺑﺎﺷﺪ. ﺑﺎ اﻳﻦ ﺣﺎل، ﻫﺮﮔﻮﻧﻪ اﺧﺘﻼل ﻣﻲﺗﻮاﻧﺪ اﻳﻦ ﻣﺪت زﻣﺎن را ﺑﻪ ﻣﻘﺪار ﻃﻮﻻﻧﻲﺗﺮي ﺗﺒﺪﻳﻞ ﻛﻨﺪ. ﻋﻼوه ﺑﺮ اﻳﻦ، ﻫﻤﻪ ﻣﺠﻤﻮﻋﻪﻫﺎي QRS، ﺷﺎﻣﻞ ﻣﻮجﻫﺎي R، Q، S ﻧﻴﺴﺘﻨﺪ. اﻧﻮاع ﻣﺨﺘﻠﻒ ﻣﺠﻤﻮﻋﻪ QRS ﻛﻪ ﻣﻲ ﺗﻮاﻧﺪ آﻧﻬﺎ را ﺑﻪ ﻋﻨﻮان ﻣﺠﻤﻮﻋﻪ QRS در ﻧﻈﺮ ﮔﺮﻓﺖ در ﺷﻜﻞ زیر ﺑﻪ ﻃﻮر ﻛﺎﻣﻞ ﻧﺸﺎن داده ﺷﺪه اﺳﺖ. در ﺷﻜﻞ، ﺣﺮوف ﺑﺰرگ و ﻛﻮﭼﻚ وﺟﻮد دارﻧﺪ ﻛﻪ ﻧﺴﺒﺖ ﺑﻪ اﻧﺪازه ﻣﻮج ﻛﻪ در اﻳﻦ ﻣﺠﻤﻮﻋﻪ وﺟﻮد دارد ﺑﻪ ﻛﺎر ﺑﺮده ﺷﺪه اﻧﺪ. ﻣﺪت، داﻣﻨﻪ، رﻳﺨﺖ ﺷﻨﺎﺳﻲ ﻣﺠﻤﻮﻋﻪ QRS، در ﺗﺸﺨﻴﺺ ﺑﻴﻤﺎري ﻗﻠﺒﻲ و آرﺗﻴﻤﻲﻫﺎي آن ﻣﻲ ﺗﻮاﻧﺪ ﻣﻔﻴﺪ ﺑﺎﺷﺪ.
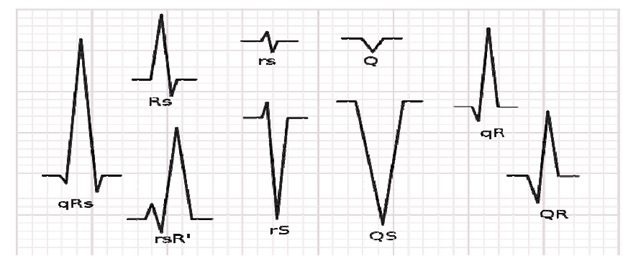
ﺷﻜﻞ ﺳﺎﺧﺘﺎرﻫﺎي ﻣﺨﺘﻠﻒ ﻣﺠﻤﻮﻋﻪ ي QRS.
ﻣﻮج :T ﻣﻮج T رﭘﻼزاﺳﻴﻮن در ﺑﻄﻦ را ﻧﺸﺎن ﻣﻲدﻫﺪ. در ﺣﺪود ٨٠ ﻣﻴﻠﻲ ﺛﺎﻧﻴﻪ ﺑﻌﺪ از وﻗﻮع ﻣﻮج S در ﻣﺠﻤﻮﻋﻪ QRS اﺗﻔﺎق ﻣﻲاﻓﺘﺪ، ﻛﻪ آن ﻫﻢ ﺑﻪ ﻓﺎﺻﻠﻪ DT ﻣﻌﺮوف اﺳﺖ. ﻓﺎﺻﻠﻪ آﻏﺎز ﻣﻮج QRS ﺗﺎ ﻧﻘﻄﻪ اوج ﻣﻮج T ﺑﻪ ﻋﻨﻮان دوره ﭘﺎﺳﺨﻲ ﻣﻄﻠﻖ ﺷﻨﺎﺧﺘﻪ ﻣﻲ ﺷﻮد. ﭘﺲ از ﻣﻮج T، ﻳﻚ دوره آراﻣﺶ ﺑﺮاي ﻣﺪﺗﻲ ﻗﺒﻞ از ﻣﺮاﺣﻞ ﺑﻌﺪي اﻧﺘﻘﺎل وﺟﻮد دارد.
شرح پروژه:
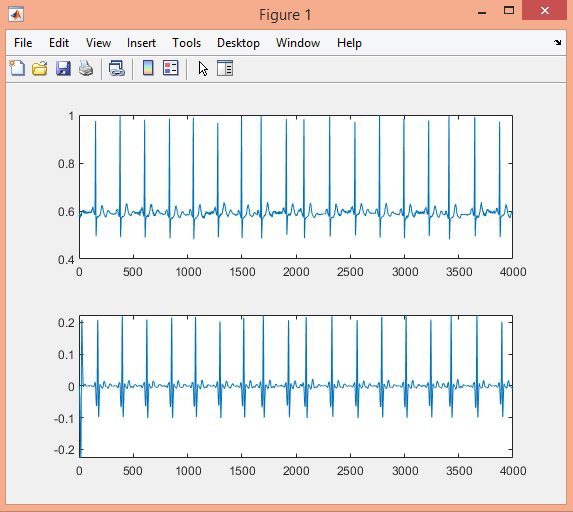
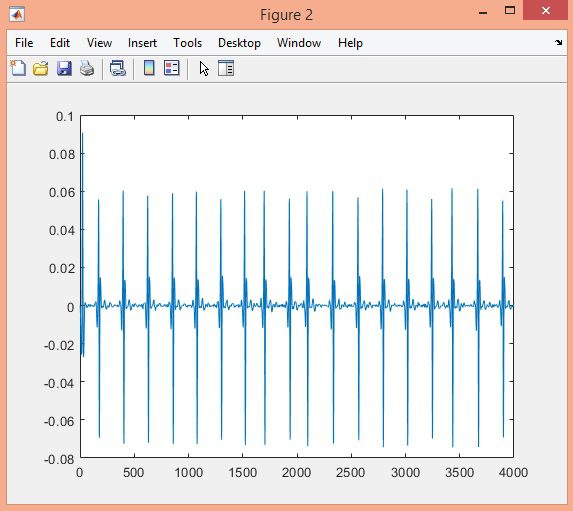
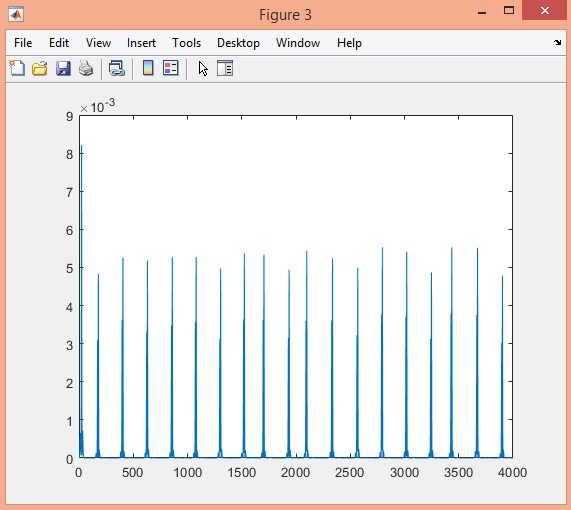
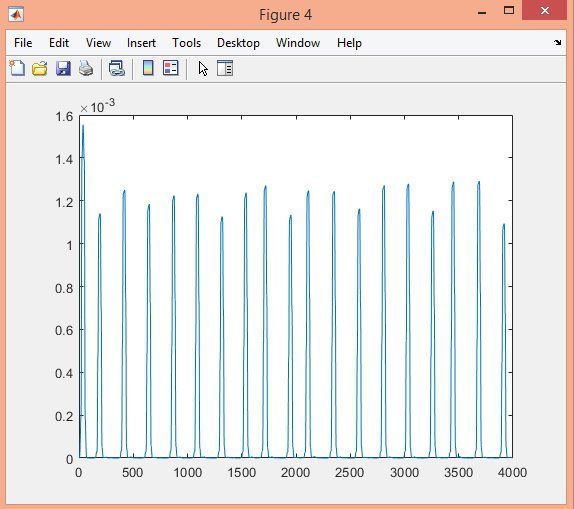
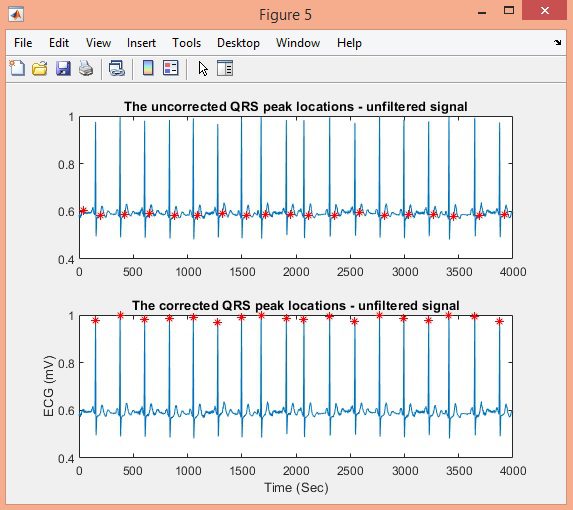
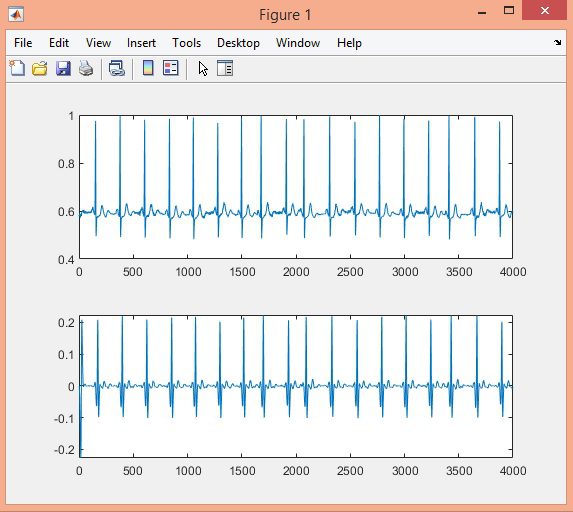
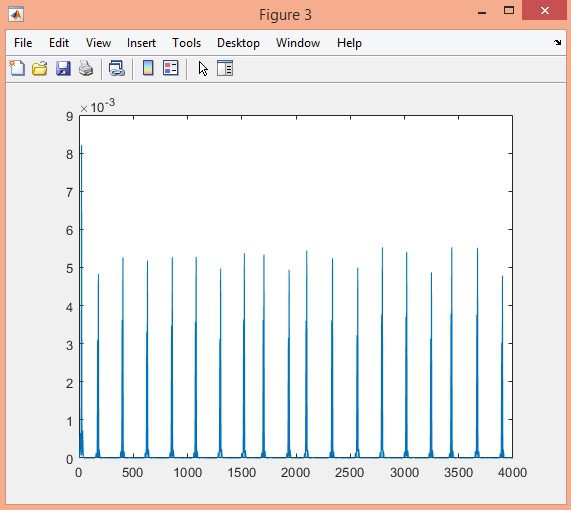
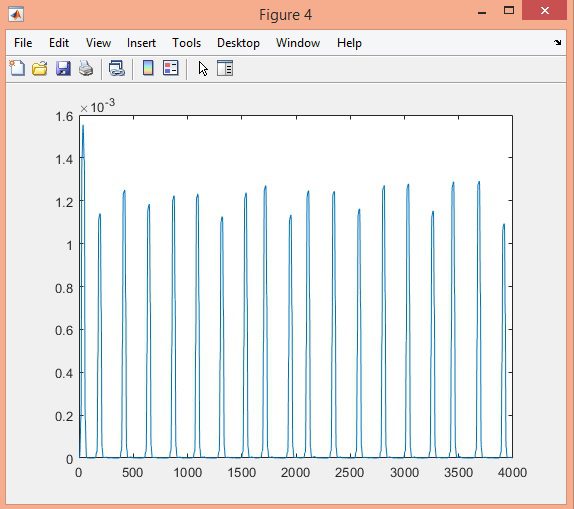
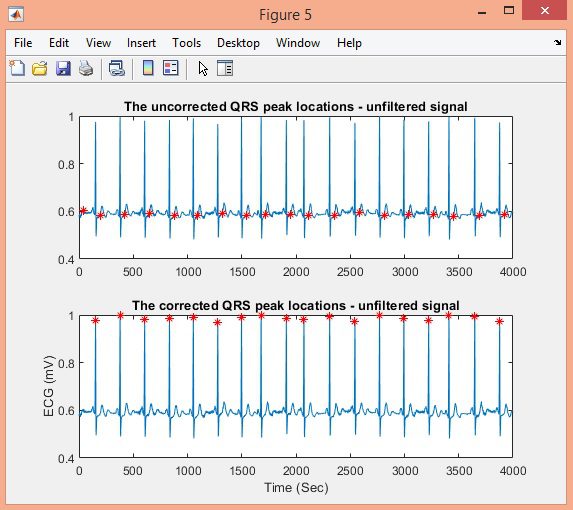
در این پروژه تشخیص کمپلکس QRS سیگنال ECG در پایگاه داده MIT-BIH با الگوریتم Pan-Tompkins، در نرم افزار متلب انجام شده است.
نتایج: