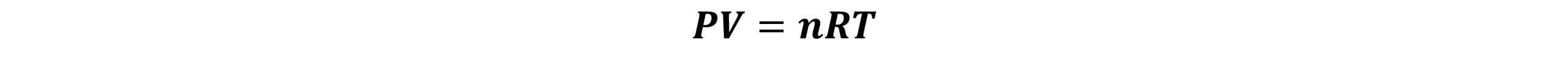توضیحات
پروژه تخمین حجم ویژه، ضریب تراکم پذیری و ضریب فوگاسیته برای بنزن(Benzene) به کمک معادلات حالت واندروالس(vdW)، ردلیچ-وانگ(RK)، سوآو-ردلیچ-وانگ(SRK) و پنگ-رابینسون(PR) در نرم افزار متلب(MATLAB)
شرح پروژه:
در این پروژه تخمین حجم ویژه، ضریب تراکم پذیری و ضریب فوگاسیته برای بنزن(Benzene) به کمک معادلات حالت واندروالس(vdW)، ردلیچ-وانگ(RK)، سوآو-ردلیچ-وانگ(SRK) و پنگ-رابینسون(PR) در نرم افزار متلب(MATLAB) کدنویسی شده است.
گازها:
گازها را بهصورت مجموعهای از مولکول ها (یا اتمها) میتوان درنظرگرفت که به صورت دایم و نامنظم در حرکت هستند. گازها به دو دسته ایده آل و حقیقی تقسیم میشوند، که دارای چهار متغیر فشار (P)، حجم (V)، دما (T) و تعداد مولها (n) هستند. باید رابطهای بین چهار متغیر وجود داشته باشد. قانون ساده گازها رابطه بین دو متغیر را وقتی که دو متغیر دیگر ثابت باشند، بیان میکند. طبق قانون بویل- ماریوت وقتی تعداد مولها و دما ثابت باشد، فشار با حجم به نسبت عکس تغییر میکند. قانون شارل- گیلوساك بیان میکند که در فشار و تعداد مولهای ثابت، حجم یک گاز با دمای آن نسبت مستقیم دارد و همچنین در حجم و تعداد مول های گازی ثابت، فشار آن گاز با دما نسبت مستقیم دارد. معادله حالت یک گاز کامل، رابطه بین چهار متغیر را بهصورت زیر بیان میکند:
در این معادله، R ثابت گاز میباشد. هر گازی که از این معادله تبعیت کند گاز کامل یا ایده آل است. اما برای گاز کامل تعریف مناسبتری نیز وجود دارد. گاز کامل گازی است که:
الف) حجم اشغال شده توسط خود مولکول های گاز (حجم خودی یا حجم مستثنی شده) قابل صرفنظر یا به عبارتی صفر باشد.
ب ) نیروهای بین مولکولی(شامل نیروهای جاذبه و دافعه) صفر باشد.
هر عاملی که گازها را به این دو شرط اساسی نزدیک کند باعث نزدیکی گازها به حالت ایده آل میشود. مثلاً افزایش حجم، افزایش دما، کاهش فشار و کاهش چگالی یا تراکم مولکول ها یا غلظت. در شرایط دما و فشار معمولی، گازهای حقیقی به طور نسبتاً کامل از قوانین گاز ایده آل پیروی میکنند. ولی در دمای پایین یا فشارهای بالا یا هر دو مورد گازهای حقیقی از گازهای ایده آل انحراف نشان میدهند. علل انحراف از حالت ایده آل نیروهای بین مولکولی و حجم مولکول هاست.
مایعات:
مایع ماده ای است که آزادی حرکت مولکول های آن بیشتر از جامدات اما کمتر از گازهاست. ذرات ریزی که مایعات را تشکیل میدهند نسبت به جامدات انرژی بیشتر، اما نسبت به گازها انرژی کمتری دارند. مایعات این تفاوت را نیز با گازها دارند که نمیتوان آنها را با فشرده کردن در فضای کوچکی جای داد. میزان مقاومت یک مایع در مقابل جاری شدن ویسکوزیته خوانده میشود. مایعات غلیظ مانند قیر ویسکوزیتهی بالایی دارند و به کندی جاری میشوند، اما مایعات رقیق مانند آب ویسکوزیتهی پایینی دارند و به راحتی جاری میشوند. کشش سطحی موجب میشود که سطح مایعات مانند نوعی پوسته عمل کند. این کشش توسط نیروهای بین مولکولهای مایع، که آنها را کنار هم نگه میدارد ایجاد میشود. در زیر سطح، مولکولهای مایع از همه طرف توسط مولکولهای دیگر احاطه شده اند، بنابراین این نیروها یکدیگر را خنثی میکنند. اما در سطح مایع، مولکولها فقط از سه طرف احاطه شده اند. این عدم تعادل، مولکول های سطح را به سمت درون میکشد و پوسته مایع را تشکیل میدهند. قطرات و حبابهای آب به دلیل کشش سطحی گرد هستند. مولکولهای سطح به سمت داخل کشیده میشوند و یک شکل کروی را تشکیل میدهند.
نظریه حالت مایع به اندازه گازها پیشرفت نکرده است و توسعه معادلات عمومی برای توصیف رفتار حجمی فاز مایع خیلی ترقی نکرده است ولی در شرایط عمومی دما و فشار، حجمهای مایعات را میتوان بهصورت تجربی بهدست آورد، البته فشار و دما و بهخصوص فشار، تأثیر نسبتًا کمی روی حجم مایع به جز در نواحی بحرانی دارد.
انواع معادلات حالت(Equation of state):
برای بیان توضیح دقیقی از رفتار PVT سیالات در دامنهی وسیعی از دما و فشار، به یک معادله حالت جامع احتیاج است. البته نباید این معادله آن قدر پیچیده باشد که مشکلات عددی یا تحلیلی اضافهای را در کاربردش به وجود آورد. از سادهترین معادلاتی که قادر به بیان رفتار مایع و بخار میباشد میتوان به معادلههای چند جملهای اشاره کرد که در آنها حجم مولی از نوع درجه سوم است.
معادله حالت گاز کامل تنها در محدوده کوچکی از دما و فشار یک گاز حقیقی قابل استفاده است، به همین منظور برای توصیف سیالات در محدوده های وسیعتر معادلههای حالت تجربی و شبه تجربی که نتایج بهتری دارند پیشنهاد و ارایه شدند.
معادلههای حالت را میتوان به سه گروه تقسیمبندی کرد: ١ – تجربی، 2- نیمهتجربی، 3- نظری.
اغلب معادلههای حالت نیمهتجربی هستند و ضرایبی که در آنها گنجانده شده، از طریق اطلاعات تجربی بهدست میآید.
معادلات حالت تجربی:
این معادلات عموماً شامل تعداد زیادی از پارامترهای ویژه با معنای فیزیکی کم هستند. اما با اینحال با داده های تجربی مطابقت داشته و بهطور نوعی برای یک سیال خاص یا گروه کوچکی از سیالات طراحی شدهاند. این دسته از معادلهها برای سیال مورد نظر خود، تحت شرایط مربوطه با دقت بالایی عمل میکنند.
معادلات حالت نیمهتجربی:
معادله حالتهای نیمه تجربی از ادغام محاسبات نظری و دادههای تجربی حاصل میشوند. معادلههای نیمهتجربی معمولاً دقت زیاد و کاربردهای فراوانی دارند. معادله حالت واندروالس یکی از معادلات حالت نیمه تجربی می باشد که در ادامه به آن اشاره می شود.
معادلات حالت مکعبی(Cubic EOS):
معادلات حالت مکعبی مدل های فشار بالای کلاسیک می باشند. از نظر ترمودینامیکی عبارت فشار بالا به فشارهایی اطلاق می شود که به اندازه ای بالا می باشند(بالاتر از 15-20 بار) که در تعادل های بخار-مایع بر روی خواص ترمودینامیکی هر دو فاز تاثیر می گذارند. تعادل های بخار-مایع در فشارهای بالا بسیار پیچیده تر از تعادل های بخار-مایع در فشارهای پایین می باشند. در فشارهای پایین عامل اصلی غیر ایده آل بودن، فاز مایع است. غیر ایدهآل بوده فاز بخار در فشارهای پایین حدوداً 10 درصد می باشد و آنرا می توان به کمک روش هایی نظیر حالات متناظر(corresponding states) و یا معادله ویریال تخمین زد. از مدت ها قبل رایجترین روش برای محاسبات تعادلی بخار-مایع در فشارهای بالا، معادلت حالت(EOS) به خصوص معادلات حالت مکعبی(Cubic EOS) هستند.
معادلات حالت مکعبی دوپارامتری و به خصوص سه پارامتری از خانواده مدل های کلاسیک اما بسیار مفید و پرکاربرد مهندسی می باشند. معروف ترین معادلات حالت عبارتند از واندروالس، ردلیچ-وانگ، و به خصوص سوآو-ردلیچ-وانگ و معادله حالت پنگ-رابینسون که دو معادله حالت اخر به طور خاص در صنایع شیمی و نفت بکاربرده می شوند. امروزه از معادلات حالت مکعبی هنوز به عنوان انتخاب اصلی برای صنایع پتروشیمی، فرآیندهای گاز و جداسازی هوا استفاده می شود.
در ادامه مروری بر این معادلات حالت انجام شده و همچنین به بررسی نقاط قوت و ضعف آنها خواهیم پرداخت.
معادله حالت واندروالس(Van der Waals):
در سال 1873 واندروالس(van der Waals) معادله حالت معروف خود را منتشر کرد که قادر بود خواص تعادلی گازهای حقیقی را توصیف نماید. وی مولکول ها را به صورت کره ای سخت درنظرگرفت که می توانند به یکدیگر نیرو وارد کنند. معادله واندروالس به صورت زیر توصیف می شود: این معادله اولین معادله درجه سوم عمومی حالت است که توسط واندروالس در سال 1873 پیشنهاد شد.
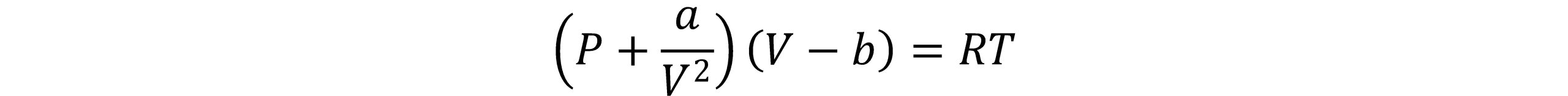
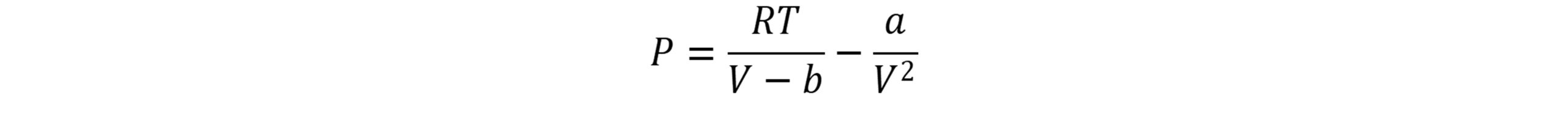
در این معادله P فشار، T دما، V حجم، n تعداد مول ها و R ثابت جهانی گازها است. مقدار ثابت b برای تصحیح حجم اشغال شده توسط مولکول ها و عبارت a/V2 تصحیح لازم برای نیروهای جاذبة بین مولکولی است. پارامتر a نشان دهنده نیروی جاذبه بین مولکول ها و پارامتر b برای درنظرگرفتن حجم مولکول ها در مقایسه با حجم کل می باشد.
a و b می توانند با اعمال شرایط نقطه بحرانی سیالات حاصل شوند:
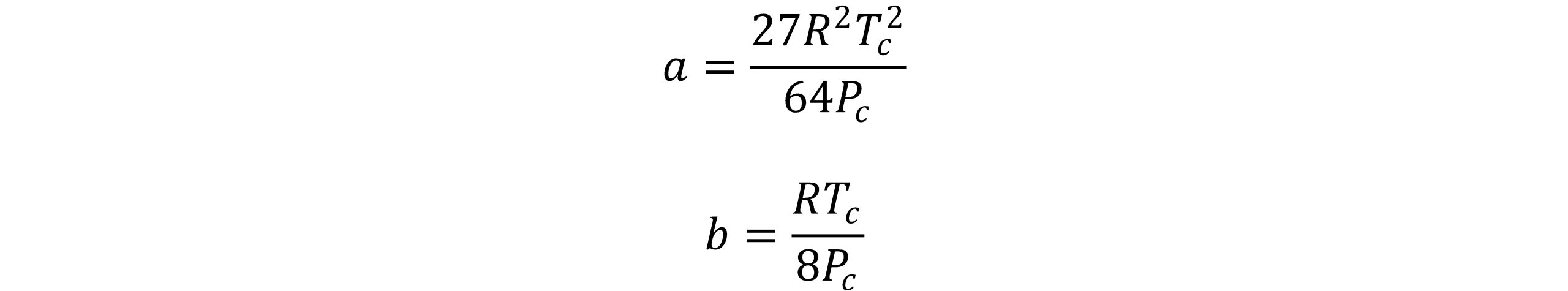
معادله واندروالس بدون توجه به نوع مواد، ضریب تراکم پذیری بحرانی Zc مواد خالص را برابر 0.375 محاسبه می کند. این معادله توسط افراد زیادی تصحیح و به معادله حالتهای بهتری تبدیل شده است.
معادله حالت ردلیچ- وانگ(RK)
این معادله حالت تا حد قابل توجهی دقیقتر از معادلهی واندروالس است. معادلهی RK توسط ردلیچ و وانگ در سال١٩٤٩پیشنهاد شد. آنها در این معادله، عبارت مربوط به دافعه را در معادله حالت واندروالس بدون تغییر نگه میدارند ولی وابستگی دمایی را در عبارت جاذبه وارد کردند.این معادله حالت به صورت زیر نشان داده شده است.
به دلیل نارسایی های معادله واندروالس، محققان بسیاری معادله حالت واندرالس را اساساً با تغییر عبارت تصحیح کننده فشار یعنی a/V2 اصلاح نمودند. از میان تمام اصلاحیه های معادله واندروالس، معادله ردلیچ-وانگ موفق ترین اصلاحیه به شمار می رود. با فاصله گرفتن از زمان ارائه معادله حالت واندروالس به تدریج اقبال به معادله وی، رو به کاهش نهاد تا آنکه ردلیچ-وانگ با معادله خود تحولی تازه را در استفاده از معادلات مکعبی به وجود آوردند. این معادله براساس دو شرط، حد پایین جرم ویژه و حد بالای جرم ویژه بنا شده است. در حد پایین جرم ویژه، معادله به گونه ای باید باشد تا مقدار معقولی برای ضریب دوم ویریال بدهد. در حد بالای جرم ویژه، این نکته درنظرگرفته شده است که در فشار بینهایت مقدار حجم کاهنده 0.26 می باشد. این دو محقق با جایگزینی عبارت v(v+b) به جای v2 در جمله جاذبه و وابسته کردن پارامتر a به دما به منظور بهبود پیش بینی فشار بخار، معادله خود را به صورت زیر ارائه کردند.
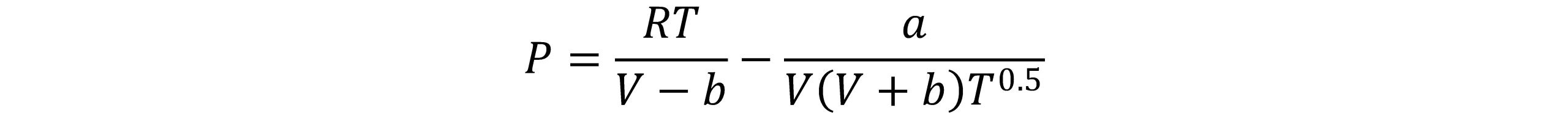
در این رابطه پارامترهای a و b برای مواد خالص به صورت زیر تعریف می شود:
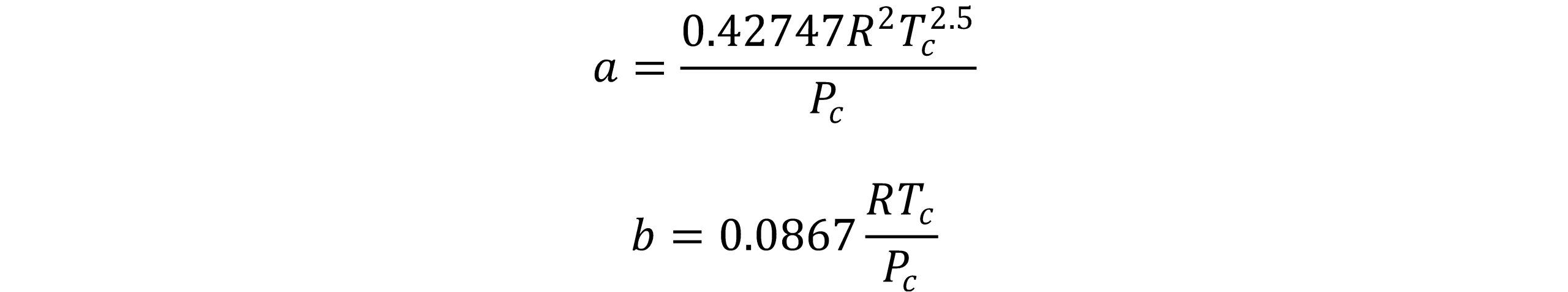
معادله RK در ناحیه وسیعی از فشار و دما از دقت بالایی برخوردار است و در محاسبات مربوط به مخلوط های دو جزئی و خصوصیات بحرانی نقطه دو فازی بخار- مایع با موفقیت مورد استفاده قرار میگیرد. برخی از حالتهای اصلاح شده این معادله در سال های اخیر کاربرد پیدا کرده اند.
معادله ردلیچ-وانگ برای پیش بینی خواص حجمی فاز بخار سیالات خالص و مخلوط ها جواب های نسبتاً دقیقی ارائه می دهد و ارزش این معادله نسبت به دیگر معادلات با ثابت های زیاد، سادگی و دقیق بودن آن می باشد. نقص این معادله، عدم توصیف دقیق فاز مایع، مواد قطبی و مخلوط های آنها و همچنین نتایج ضعیف برای ضریب فوگاسیته مخلوط ها می باشد. نتایجی که با این معادله بدست آمده نشان می دهد که درصد خطا با بالارفتن ضریب بی مرکزی(Acentric factor) مواد، افزایش می یابد.
اگرچه معادله حالت ردلیچ-وانگ برای محاسبه خواص مخلوط های گازی بسیار موفق عمل کرده است، اما هنوز برای مدلسازی هر دو فاز مایع و گاز از دقت کافی برخوردار نمی باشد. این به دلیل وابستگی ساده پارامتر جاذبه به دما می باشد.
معادله حالت سوآو- ردلیچ- وانگ(SRK):
در سال 1972 سوآو معادله حالت ردلیچ-وانگ را اصلاح نمود. این اصلاحیه شامل توسعة یک عبارت وابسته به دمای تعمیم یافته برای عبارت جاذبه a در معادله RK و جایگزینی عبارت At -0.5 با یک عبارت وابسته به دمای عمومی تر یعنیa(T) می باشد. سوآو و همکارانش با استفاده از اصلاحات تجربی که روی معادله حالت ردلیچ- وانگ (RK) انجام دادند در سال ١٩٧٢ این معادله را بدست آوردند. آنها پیشنهاد کردند که ضریبa/T0.5 با a(T) که در رابطهی زیر ارایه شده است و وابستگی کمتری نسبت به دما دارد جایگزین شود:
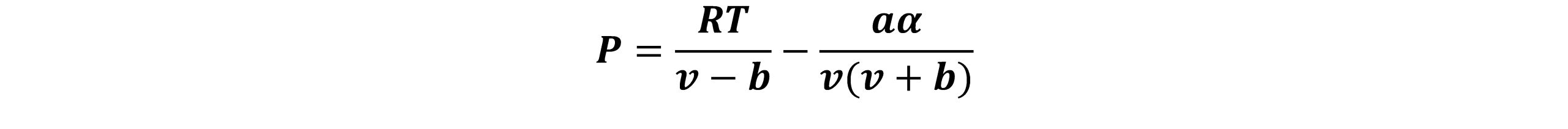
ثابت های معادله فوق به صورت روابط زیر توصیف می شوند:
سوآو پارامتر آلفای موجود در معادله ردلیچ-وانگ را به صورت تابعی از دمای کاهنده و ضریب بی مرکزی درنظرگرفت و معادله حالت سوآو-ردلیچ-وانگ(SRK) که بعدها یکی از پرطرفدارترین معادلات حالت در صنعت نفت می باشد، ارائه نمود.
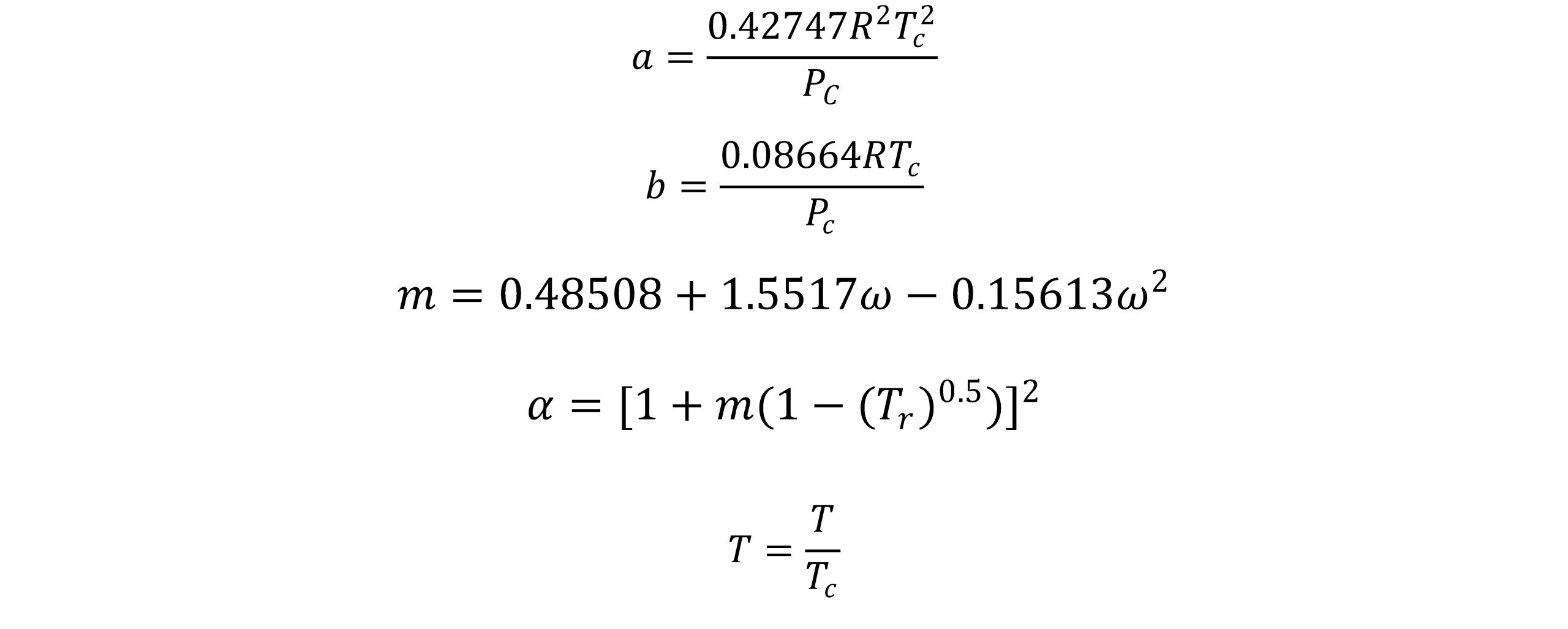
در رابطه فوق، w ضریب ناکروی می باشد.
استفاده از این معادله حالت در تعادل فاز بخار- مایع برای ٩٥سیستم نشان داد که نسبت به معادله ردلیچ- وانگ انطباق بهتری با داده های تجربی دارد و همچنین دقت محاسبات در نقطه بحرانی مخلوطها نیز بهبود یافت.
معادله حالت پنگ-رابینسون(Peng Robinsion EOS)
در سال 1976 پنگ و رابینسون بیان نمودند که معادله SRK حجم مایع اشباع را ضعیف پیش بینی می کند و مقدار پیش بینی شده ضریب تراکم پذیری Zc، حجم مایع اشباع پیش بینی شده بوسیله معادله را تحت تاثیر قرار می دهد. آنها معادله حالتی را ارائه نمودند که مقادیر معقولی را برای دانسیته مایعات هیدروکربنی پیش بینی می کرد. معادله آنها به صورت زیر است:
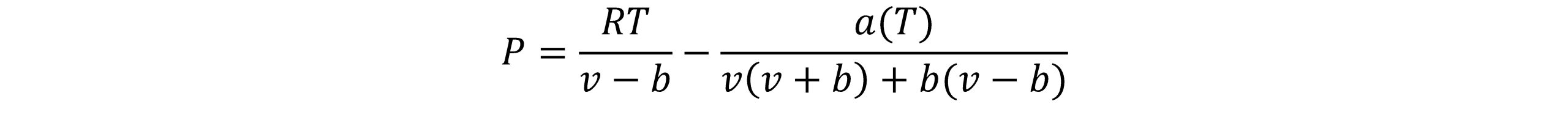
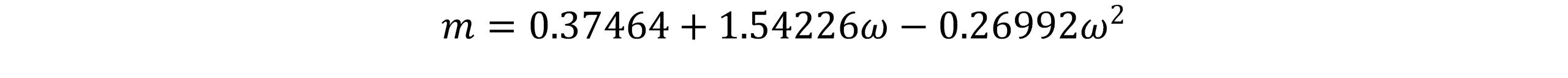
همچنین ac و b به صورت زیر تعریف می شوند:

معادله پنگ- رابینسون برحسب ضریب تراکم پذیری Z بصورت زیر نوشته می شود:
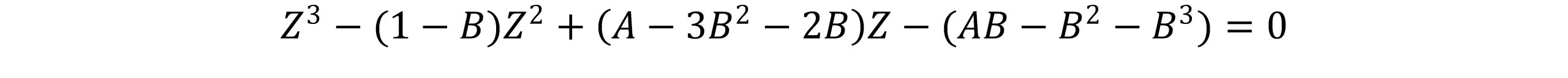
که A و B از روابط زیر محاسبه می شوند.
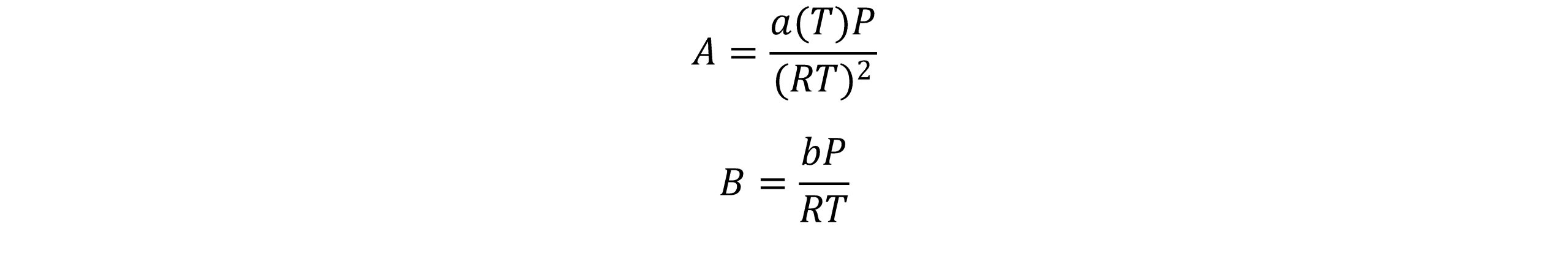
پنگ و رابینسون باتوجه به این نکته که ضریب تراکم پذیری بحرانی که از معادله حالت SRK بدست می آید(0.333) عملاً از ضریب تراکم پذیری همه سیالات بیشتر است،کوشش کردند تا این نقیصه را بهبود دهند. معادله پیشنهادی آنها ضریب تراکم پذیری بحرانی را تا 0.307 کاهش داد. معادله حالت پنگ-رابینسون برای هیدروکربن ها با اندازه متوسط و ترکیبات دیگری با ضریب بی مرکزی متوسط، حجم مایع را بهتر پیش بینی می کند. اما برای ترکیباتی با ضریب بی مرکزی کوچک نسبت به معادله حالت SRK ضعیف تر است.
فوگاسیته(fugacity):
استفاده از پتانسیل شیمیایی در محاسبات تعادلی هنگامی که پتانسیل شیمیایی برابر بینهایت شود باعث سخت شدن محاسبات می گردد. بدین گونه برای برخی از سیستم ها، استفاده از فوگاسیته به جای پتانسیل شیمیایی راه حل مناسبی می باشد. رفتار تابع گونه در بسیاری از حالات بهتر و از رابطه زیر محاسبه می گردد:

فوگاسیته هم واحد فشار بوده و در سیستم های گاز ایده آل به طور عمومی همان نقش فشار را ایفا می کند. هنگامیکه فشار به سمت صفر میل می کند، گاز شبیه به گاز ایده آل رفتار می نماید. بنابراین فوگاسیته یک جزء خالص در فشارهای نزدیک به صفر برابر فشار می باشد. از لحاظ ریاضی می توان نشان داد که:
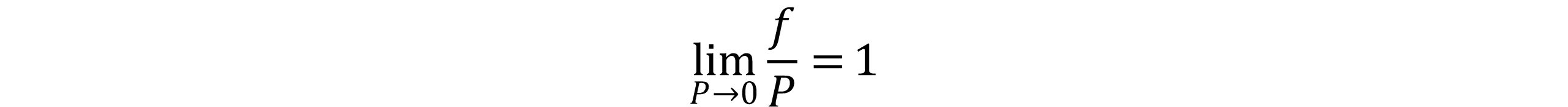
دو رابطه فوق بیانگر تابع فوگاسیته می باشد که با قراردادن در رابطه μ=RTln(f) معیار تعادل فازی به صورت زیر تعریف می گردد:
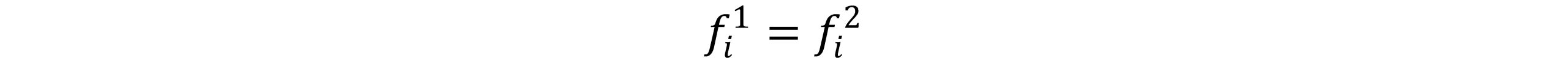
بنابراین یک سیستم چندفازی که شامل چند جزء است، شرط تعادل برابری فوگاسیته یک جزء در تمامی فازها می باشد.
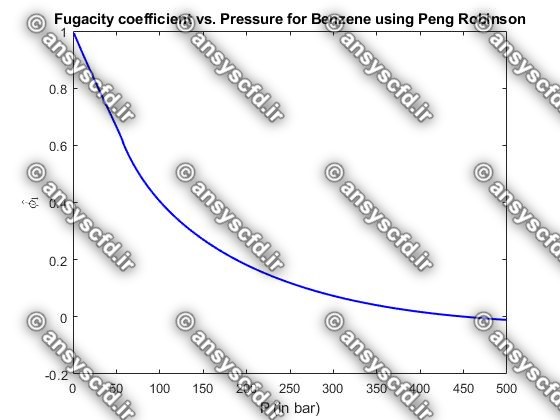
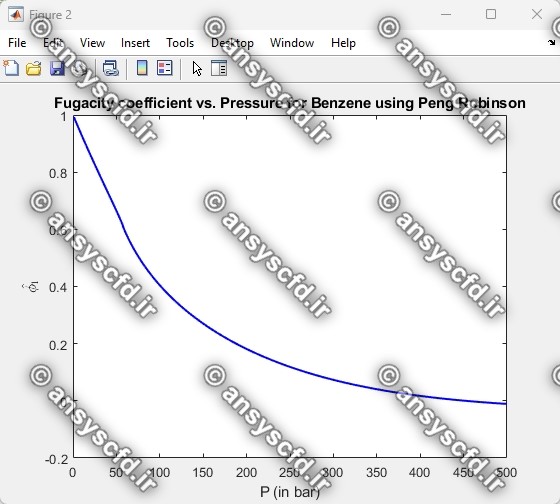
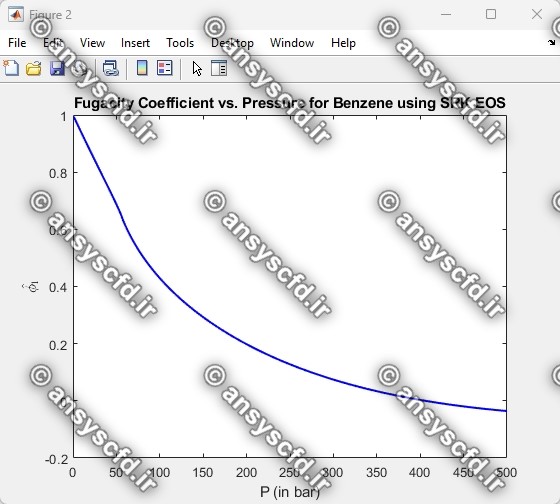
ضریب فوگاسیته(Fugacity Coefficient):
ضریب فوگاسیته برای یک جزء خالص به صورت زیر تعریف می شود:
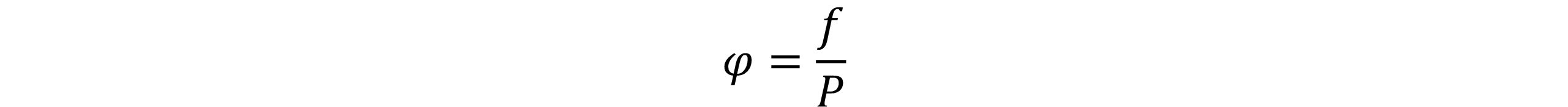
بنزن(Benzene):
بنزن با فرمول (C6H6) یک مایع شفاف بی رنگ تا متمایل زرد کمرنگ، قابل اشتعال با بوی آروماتیکی است. چگالی بنزن از آب کمتر می باشد و کمی در آب قابل حل است. بنابراین بر روی آب شناور می شود. بخار بنزن سنگینتر از هوا است. بنزن در ترکیبات نفت خام وجود دارد و یکی از فراورده های فرآیندهای پالایش نفت خام می باشد. بنابراین محدودیت هایی بر روی محتوای بنزن در بنزین وجود دارد. در صنعت بنزن به عنوان یک حلال آلی، و ترکیب میانی شیمیایی استفاده می شود و در سنتز ترکیبات شیمیایی مختلف بکاربرده می شود. دیاگرام فازی بنزن به صورت شکل زیر نشان داده می شود.
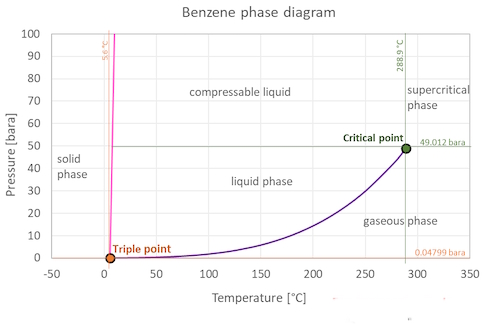
بنزن در شرایط استاندارد به صورت مایع است. اما با افزایش دما به حالت بخار در می آید و زمانیکه سرد شود حالت جامد دارد. دیاگرام و نمودار فازی بنزن، رفتار فازی را همراه با تغییرات در دما و فشار نشان می دهد. منحنی بین نقطه بحرانی و نقطه سه گانه(triple point) تغییرات نقطه جوش بنزن با فشار را نشان می دهد. همچنین این نمودار، تغییرات فشار اشباع با دما را نیز نشان می دهد. در نقطه بحرانی هیچ تغییر حالتی در صورت افزایش فشار یا افزایش دما دیده نمی شود. نقطه سه گانه یک ماده، دما و فشاری است که در آن نقطه سه فاز (گاز، مایع، و جامد) به طور همزمان در تعادل ترمودینامیکی وجود دارند.
محدوده کاربرد معادلات حالت مکعبی برای بنزن به صورت زیر می باشد:
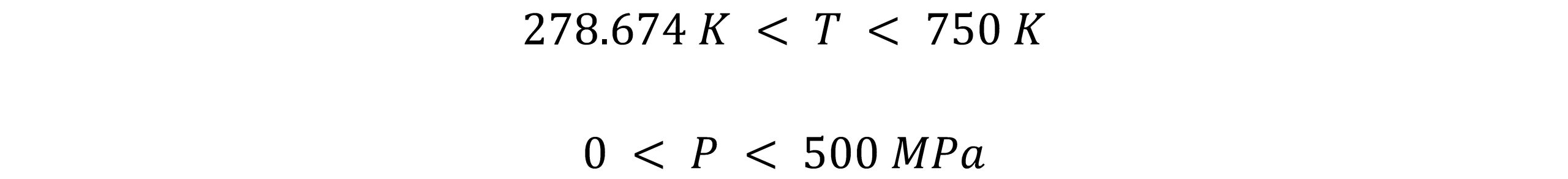
محدوده کاربرد معادلات حالت مکعبی برای بنزن برای دماهای تا حداکثر 750 کلوین و تا حداکثر فشار 500 مگاپاسکال می باشد.
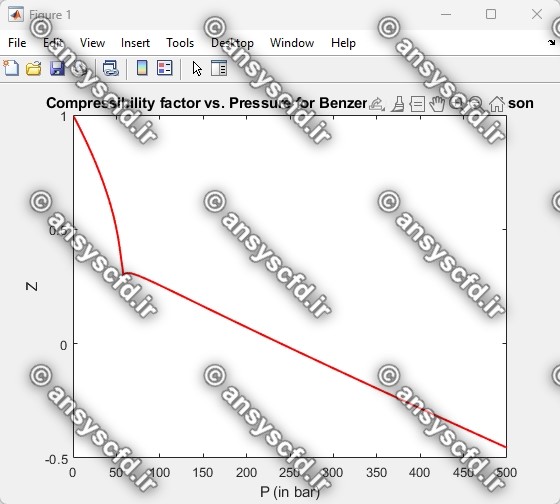
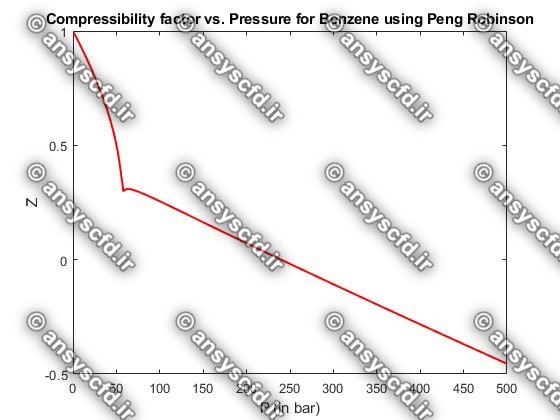
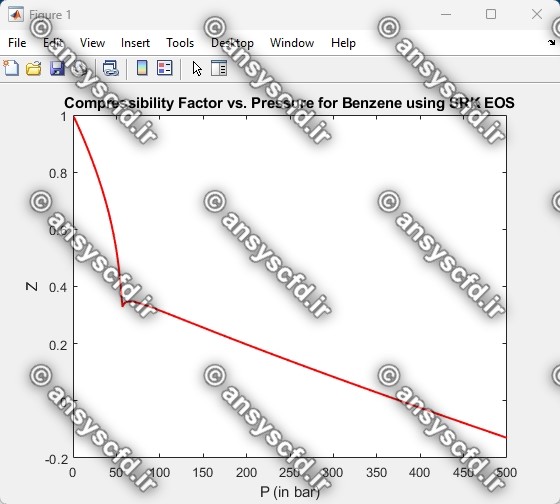
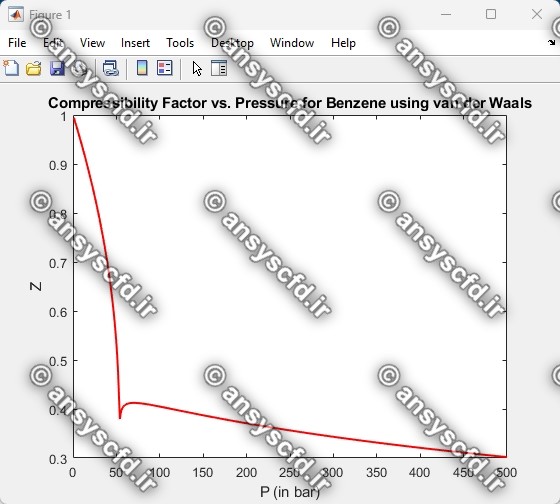
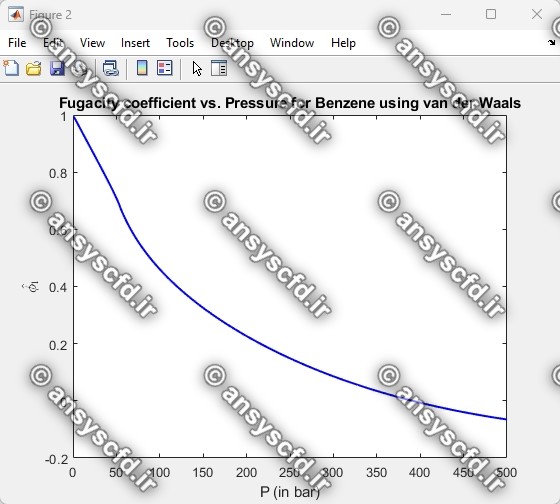
نمونه نتایج