توضیحات
آموزش ویدیویی پروژه شبیه سازی سیستم میکروفلوئیدیک برای جداسازی سلول های گلبول های قرمز خون و پلاکت ها در نرم افزار کامسول(COMSOL)+فایل های پروژه
شرح پروژه:
در این محصول آموزشی، علاوه بر آموزش ویدیویی شبیه سازی سیستم میکروفلوئیدیک برای جداسازی سلول های گلبول های قرمز خون و پلاکت ها در نرم افزار کامسول، فایل های کامل پروژه(کامسول) و تصاویر مرحله به مرحله از اجرای پروژه و گزارش فارسی پروژه را نیز دریافت خواهید کرد.
مدت فیلم آموزشی 49 دقیقه
**توجه**
**تمامی فیلم های آموزشی با کیفیت بالا و بدون رکورد صدا توسط پژوهشگران مجموعه انسیس سی اف دی ضبط و تهیه شده اند**
خون:
خون مایع اصلی داخل بدن می باشد که وظیفة اصلی آن رساندن اکسیژن و مواد مغذی به سلول ها، دفع مواد زائد و دفاع از بدن می باشد. علاوه بر این خون به عنوان یک بافت نیز نامیده می شود به دلیل اینکه خون از مجموعه ای از سلول ها تشکیل شده است که هرکدام وظيفه خاصی را بر عهده دارند. در حدود ۷ الى 8 درصد وزن بدن را خون تشکیل می دهد و در انسان بالغ به طور متوسط ۵ لیتر از حجم بدن را خون تشکیل می دهد. به طور کلی خون یک سیال غیرنیوتونی است که از 55 درصد حجمی پلاسما و 45 درصد حجمی سلول تشکیل شده است.
پلاسما:
پلاسما مایع زردرنگی است که در حدود 55% حجمی خون را تشکیل می دهد. پلاسما از 91 درصد آب، 7 درصد پروتئین ها، 1 درصد املاح معدنی و 1 درصد باقیمانده شامل ویتامین ها، مواد قندی و مواد لیپیدی، هورمون ها و اسیدهای آمینه می شود.
گلبول های قرمز:
گلبول های قرمز دارای بیشترین فراوانی در مقایسه با بقیة سلول های خونی می باشند. قطر گلبول های قرمز بالغ در حدود 6 تا 8 میکرومتر است که به صورت میانگین 7.6 میکرومتر در نظر گرفته می شود. غلظت این سلول ها در خون مردان و زنان بالغ به ترتیب برابر با 3.6 تا 5.5 میلیون و 4.1 تا 6 میلیون بر میکرولیتر می باشد.
هماتوکریت به درصد حجمی این گلبول ها در داخل خون می باشد که در مردان و زنان بالغ به ترتیب برابر با 45 درصد و 40 درصد است.
گلبول های سفید:
گلبول های سفید به صورت تقریبی 1 درصد حجمی خون را تشکیل می دهند. گلبول های سفید، که خود به 5 دسته تقسیم می شوند، وظیفه دفاع از بدن در مقابل بیماری ها را برعهده دارند. به طور کلی در افراد سالم غلظت این سلول ها در داخل خون بین 4000 تا 11000 عدد بر میکرولیتر است.
سلول های سرطانی در گردش:
سلول های سرطانی در گردش سلول هایی هستند که از یک بافت سرطانی جدا شده اند و در داخل خون جریان دارند. به این مرحله از بیماری سرطان در اصطلاح متاستاز گفته می شود. سلول ها می توانند به وسیله جریان خون به بافت های حیاتی بدن بروند. این رویه یکی از رایج ترین روش هایی است که سرطان سبب مرگ فرد می شود.
سلول های سرطانی در گردش اولین بار توسط آشورت در سال 1869 در جریان خون فردی که مبتلا به سرطان متاستاز بوده، مشاهده شد. مطابق نتیجه گیری آشورت این سلول ها دلیل ایجاد تومورهای سرطانی در مکان های مختلف در بدن بیمار می باشند. اهمیت مطالعه سلول های سرطانی به دهه 1990 برمی گردد. در این دهه آلارد و همکارانش سلول های سرطانی در گردش در خون را در مراحل ابتدایی سرطان متاستاز مشاهده کردند. از آن پس بسیاری از تکنولوژی ها برای شمارش و شناسایی سلول های سرطانی مورد استفاده قرار داده شده است. روش مرسوم در بررسی بیماری سرطان نمونه برداری است.
نمونه برداری از بیمار از معایبی رنج می برد که ضرورت توسعه روش های نوین در این زمینه احساس میگردد. نمونه برداری یک روش مخرب است و نمی تواند بیمار چندین نمونه برداری را تجربه کند. علاوه بر این نمونه برداری نمی تواند معیاری را برای مفید بودن روش درمان و همچنین پیشرفت بیماری را ارائه دهد. در حالی که نمونه برداری از خون مزایای بسیاری دارد که می توان به بررسی پیشرفت بیماری، راستی آزمایی روش معالجه، قابلیت تکرار آزمایش و غیر مخرب بودن آزمایش اشاره کرد. مشکل پیش رو در شمارش سلول های سرطانی در گردش در خون تعداد بسیار معدود آنها در مقایسه با سلول های دیگر است. به طور تقریبی در هر میلی لیتر خون فرد مبتلا به سرطان در مرحله متاستاز کمتر از ۵۰ سلول سرطانی در گردش وجود دارد.
روش های مورد استفاده در جداسازی سلول های سرطانی در گردش در داخل خون:
جداسازی و مرتب سازی سلول هایی که در بستر میکروسیالی قرار دارند در شاخه های مختلف پزشکی نظير سرطان شناسی و مطالعه سلول های بنیادی کاربرد دارند. جداسازی سلول های هدف از خون یکی از رایجترین و موثرترین روش ها در زمینه های تشخیصی و درمانی می باشد. در این زمینه جداسازی سلول هایی که کمترین تعداد را دارند در تشخیص بیماری های کشنده ای نظیر مالاریا، سرطان، و اچ.آی.وی نقش اصلی را بازی می کنند. به عنوان مثال، جداسازی سلول های سرطانی سرگردانی از خون در تشخیص بیماری سرطان در مرحله متاستاز و مرحله کنترل بیماری کاربرد دارد.
روش های جداسازی سلول های سرگردان سرطانی بطور کلی به دو دسته کلی زیر تقسیم می گردند:
روش های فعال:
در روش های فعال برای جداسازی ذرات از یک میدان نیروی خارجی استفاده می شود. روش های فعال برحسب ماهیت نیرویی که برای جداسازی ذرات از آن بهره می برند به چهار دسته کلی تقسیم می شوند:
دی الکتروفورسیس، ، مگنتوفورسیس، آكوستوفورسیس، و چنگال های نوری.
روش های غیرفعال:
در روش های غیر فعال بر خلاف روش های فعال از نیروی خارجی برای جداسازی استفاده نمی شود. در این نوع جداسازی، مکانیزم مورد استفاده هندسه و نیروهای غیرخطی هیدرودینامیکی هستند. در این روش ذرات با توجه به تفاوت در خواص فیزیکی از جمله چگالی، اندازه و شکل پذیری از یکدیگر جدا می شوند. باریکه جریان خارجی، فیلتراسیون هیدرودینامیکی، و جابجایی عرضی معین می باشند. هرکدام از روش های مطرح شده مزایا و معایب خاص خود را دارند که در هر کدام در بعضی کاربردها می توانند مورد استفاده واقع شوند.
روش های جداسازی سلول های سرطانی در گردش در مقالات را می توان به چهار دسته ی کلی زیر تقسيم نمود :
- جداسازی سلول های سرطانی در حال گردش با استفاده از اختلاف در اندازه، چگالی و شکل پذیری.
- جداسازی با استفاده از دی الكتروفورسیس
- جداسازی سلول های سرطانی با استفاده از موج های آکوستیک
- جداسازی سلول های سرطانی با استفاده از اعمال میدان مغناطیسی
هر یک از این روش ها با ذکر مثال در زیر توضیح داده خواهد شد.
جداسازی با استفاده از دی الکتروفورسیس(Dielectrophoresis یا DEP):
این روش از تفاوت در میزان قطبی شدن سلول های سرطانی و سالم برای جداسازی استفاده می نماید، بدین منظور سیال در یک میدان غیر یکنواخت الکتریکی قرار می گیرد.
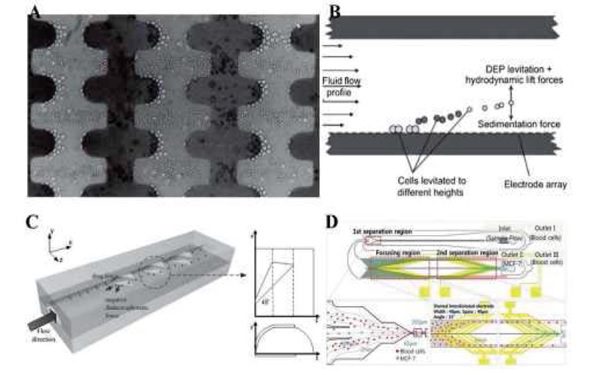
شکل جداسازی با استفاده از تفاوت در خواص قطبی شدن ذرات در حضور میدان الکتریکی.
جداسازی سلول های سرطانی با استفاده از موج های آکوستیک:
این روش اخیراً در سال ۲۰۱۴ توسط دانشگاه ایالتی ماساچوست پیشنهاد شده است که زاویه موج آکوستیک اعمال شده بر جریان سیال بهینه سازی شده است و مقدار بهینه آن برای ماکزیمم شدن تعداد سلول های سرطانی جدا شده بدست آمده است در زیر طرحی شماتیک از این روش آمده است.
شکل دستگاه جداسازی سلول های سرطانی با استفاده از موج های آکوستیک.
جداسازی با استفاده از اعمال میدان مغناطیسی به سیال :
تا اینجا کلیه روش ها بدون استفاده از پادتن بوده اند حال در این روش باید در صورتی که نوع سرطان مشخص باشد آنتی بادی های سلول سرطانی مورد نظر را به سطح ذرات مغناطیسی متصل کرده و وارد خون گردند تا آنتی بادی ها به سطح آنتی ژن روی سلول سرطانی متصل شوند تا بدین منظور سلول های سرطانی خاصیت مغناطیسی پیدا کرده و در داخل میدان به سمت صفحات مغناطیسی جذب گردند. در کلیه این روش ها یک مرحله آماده سازی مورد نیاز می باشد. بدین منظور با عبور خون که در آن سلول های سرطانی در حال گردش نشانه گذاری شده اند از یک کانالی که میدان مغناطیسی در راستای کانال ایجاد شده است می گذرند.
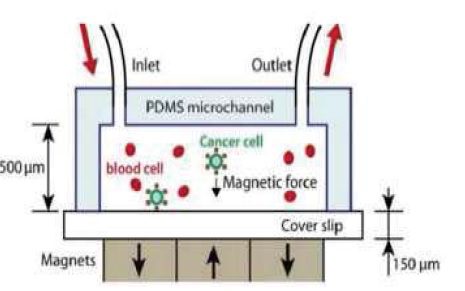
شکل جداسازی سلول های سرطانی با استفاده از پادتن
همانطور که مشاهده می شود به سلول های سرطانی که حال خاصیت مغناطیسی دارا می باشند یک نیرویی به سمت صفحه وارد می گردد که اگر این نیرو به اندازه کافی بزرگ باشد سبب می شود سلول های سرطانی جذب صفحه شده و از سلول های خونی سالم که از خروجی خارج می گردند جدا بگردند. اگرچه این روش سبب جداسازی ۸۰ تا ۹۰ درصد سلول های سرطانی میگردد اما احتمال از بین رفتن سلول های سرطانی به علت تنش های وارد شده بر آن ها وجود دارد بدین منظور اینگبر و همکارانش یک روش دیگر برای این جداسازی پیشنهاد دادند که در آن دستگاه شامل یک میکروکانال اصلی و چندین محفظه می باشد که به صورت عمودی به میکروکانال اصلی وصل می گردد.
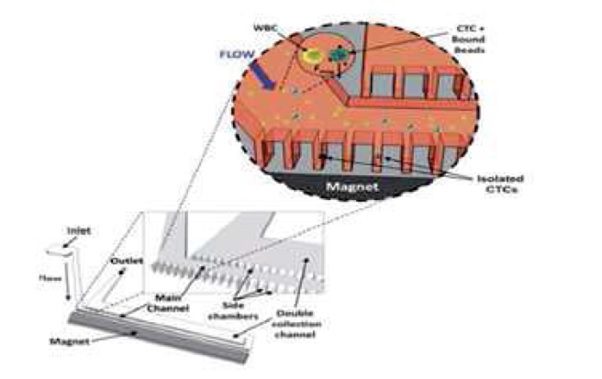
شکل کاهش تنش با استفاده از ایجاد چندین محفظه.
همانطور که در شکل دیده می شود آهنرباها در کنار محفظه قرار می گیرند تا سلول های سرطانی وادار به ورود به داخل محفظه ها بشوند که در این روش تنش وارد بر سلول های سرطانی که در داخل این محفظه ها به آنها وارد می گردد کمینه شده و سلول ها زنده می مانند. با استفاده از این روش با عبور جریان خون، سلول های سرطانی دارای خاصیت مغناطیسی، داخل محفظه ها به دام افتاده و از خون جدا می شوند.
جداسازی با استفاده از میکروکانال مارپیچ :
در این روش همانطور که در شکل زیر مشاهده می شود، سیال از داخل یک میکروکانال مارپیچ عبور داده می شود.
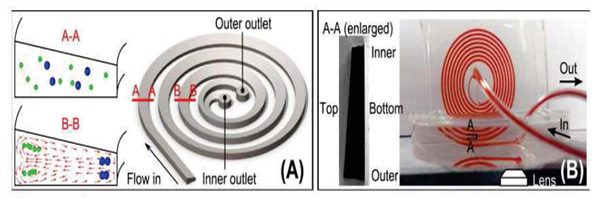
شکل میکروکانال مارپیچ.
سیال در این روش وارد یک میکرو کانال مارپیچ شده و از دو خروجی متفاوت از سمت دیواره داخلی میکرو کانال و دیواره خارجی خارج میگردد. این روش به تازگی برای اولین بار در سال ۲۰۰۸ توسط كنتاگوداناهیل و همکارانش که ارائه گردید.
سلول های سرطانی در گردش(CTC):
سلول های سرطانی در گردش سلول هایی هستند که از تومور اصلی نشئت گرفته و توسط عروق خون یا لنف در بدن پراکنده می شوند. این سلول ها با رسیدن به موقعیت جدید مناسب، توانایی ایجاد تومورهای جدید با خواصی مشابه یا متفاوت با تومور اولیه را دارند. تشخیص و جداسازی این سلول ها از خون، امکان شمارش و مطالعه بر روی CTC ها را فراهم می کند. میزان شیوع سرطان در بدن و درصد پیشرفت آن با بررسی CTC ها امکان پذیر است. به علاوه با بررسی ژنتیک CTC ها و اثر سنجی داروهای مختلف روی آنها، تشخیص روش های درمانی مناسب برای از بین بردن این سلول ها عملی می شود. جداسازی CTC ها از خون از پنجاه سال پیش مورد اهمیت قرار گرفته است و روش های بسیاری برای این امر معرفی شده است. میکروفلوئیدیک به عنوان ابزاری دقیق و مناسب برای جداسازی CTCها از سایر سلول های خون در دو دهة اخیر مورد توجه قرار گرفته است.
میکروفلوییدیک(Microfluidics):
میکروفلوئیدیک، علم و فناوری بررسی دستگاه هایی که قابلیت کارکردن با سیالات در اندازههای بسیار کوچک (8- 10- 9- 10 لیتر) را دارند است. در این فناوری از کانالهایی با ابعاد ده ها تا صدها میکرومتر استفاده می شود. میکروفلوئیدیک در علوم مختلف، از سنتزهای شیمیایی و آنالیزهای زیستی، تا اپتیک و فناوری اطلاعات کاربردهای فراوانی دارد. میکروفلوئیدیک نخستین بار به دلیل ویژگی های منحصر به فرد آن در آنالیزهای آزمایشگاهی مورد استفاده قرار گرفت. این ویژگیهای منحصر به فرد عبارت اند از امکان انجام سنجش با مقادیر کم نمونه و معرفی انجام جداسازیها با دقت و حساسیت بالا، قیمت پایین و زمان کم انجام سنجش پیدایش و پیشرفت میکروفلوئیدیک چهار منبع اصلی دارد که عبارت اند از آنالیز مولکولی، دفاع زیستی، زیست شناسی مولکولی، و میکروالکترونیک.
دستگاه های میکروفلوئیدیکی جداسازی سلول ها:
دستگاه های فعال تفکیک سلول ها:
در سیستم های جداسازی فعال، از اعمال نیروهای خارجی از قبیل نیروهای الکتریکی یا میدان مغناطیسی یا صوتی برای هدایت و کنترل سلول ها استفاده می شود. این دستگاه ها، توانایی کنترل دقیق و سرعت عمل نسبتا بالایی دارند.
جداسازی به شیوه الکتروفورز و دی الکتروفورز:
جداسازی با کمک میدان الکتریکی به دو شیوه الکتروفورز و دی الکتروفورز انجام پذیر است. الکتروفورز، جابجایی ذرات، ناشی از اثر میدان الکتریکی بر مقدار خالص بار آزاد آنها است. درنتیجه این روش مبتنی بر خواص سطحی غشاء سلول است. این روش برای جداسازی ویروس ها، باکتری ها از سلول های یوکاریوت به کار رفته است اما بار خالص سطحی معیار مناسبی برای تفکیک ملقمه ای از سلول ها با خواص نسبتا مشابه نیست. در نتیجه روش دی الکتروفورز ابداع شده است که علاوه بر خواص غشاء، خواص سیتوپلاسم هم در آنها تاثیرگذار است. دی الکتروفورز، شیوه ی جداسازی مبتنی بر تفاوت در قطبیت پذیری و اندازه ذرات است. وقتی میدان الکتریکی بر ذرات اعمال می شود، ذرات قطبی می شوند. بین این قطبیت القایی، و میدان اعمال شده فعل و انفعالاتی صورت می گیرد که باعث می شود خالص نیروی الکتریکی وارد بر هر ذره، منحصر به خود آن ذره باشد. بزرگی این نیروی خالص، وابسته به خواص دی الکتریکی ذرات (اندازه ذرات و قطبیت پذیری آنها در معرض جریان)، فرکانس و شدت میدان الکتریکی و خواص الکتریکی سیال است
جریان الکتریکی در روش الکتروفورز، می تواند به صورت مداوم یا منقطع بر دستگاه اعمال شود. در آزمایشگاه بر روی تراشه، جریان متناوب مطلوب تر است. برای این منظور از آرایش مختلف الكترودها استفاده می شود.به عنوان مثال، برای اینکه الکترودها مانع عبور جریان نشوند، آنها را به صورت زاویه دار و در آرایش های مختلف همگرا و واگرا قرار می دهند.
در جداسازی CTCها به روش الکتروفورز، با توجه به خواص متفاوت از جمله اندازه سلول های سرطانی و خواص دی الکتریک آنها با بقیه می سلول های خون، جداسازی انجام می شود. معمولاً، CTC ها جذب الكترود شده و به آن می چسبند و بقیه سلول های خون همراه با جریان به حرکت خود ادامه می دهند تا از دستگاه خارج شوند. مزیت این روش نسبت به برخی روش ها این است که می توان سلول ها را بدون اینکه طی فرآیند جداسازی آسیب ببینند، تفکیک کرد. همچنین، این روش، بدون نیاز به برچسب گذاری سلول ها هم انجام پذیر است که هزینه و دردسر کمتری دارد.
در روش دی الکتروفورز، امکان جمع آوری و کشت مجدد سلول ها برای استفاده های بعدی، از جمله تست داروها میسر است. روش اعمال جریان الکتریکی برای آزمودن اثربخشی داروها نیز مورد استفاده قرار گرفته است. به عنوان مثال، برای بررسی میزان دقيق اثربخشی داروی آرسنیک تری اکسید (As2O3) که در حال حاضر در درمان سرطان خون مورد استفاده قرار می گیرد، مقادیر مختلف As2O3، به دستگاه جداساز دی الکتروفورز فعال(DACS) حاوی سلولهای سرطان خون رده K562 تزریق شده است و با جداسازی سلولهای زنده از بقیه سلول ها، و بررسی نرخ مرگ آنها، تأثیر این دارو بر روی سلول ها مشخص شده است. با این روش، غلظت و بازه های زمانی مناسب برای موثر واقع شدن دارو، مشخص می شود.
معروفترین دستگاه تجاری تفکیک سلولی که از دی الکتروفورز بهره می برد، دستگاه Apo cell است. این دستگاه برای اولین بار در سال 2009 به بازار عرضه شده است و CTCها را بدون نیاز به هر گونه برچسب گذاری و بر حسب تفاوت در خواص دی الکتریکی آنها از خون جدا می کند.
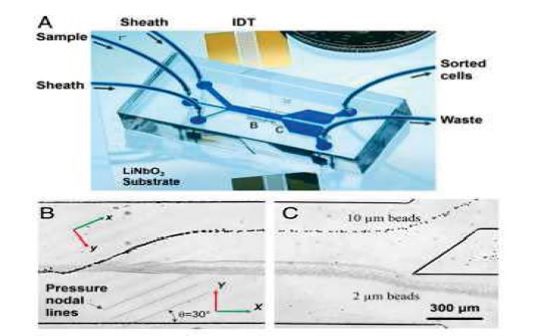
جداسازی بر مبنای میکروفلوییدیک اینرسی:
دستگاه های میکروفلوییدیک اینرسی ابتدا به منظور متمرکز و مرتب سازی ذرات ابداع شدند. اولین دستگاه در سال 2007 توسط گروه دی کارلو معرفی شد. در این دستگاه که ساختار هندسی مارپیچی داشت، ذرات پراکنده در سیال با آرایش نامنظم و اتفاقی وارد دستگاه شده و به صورت منظم روی یک خط جریان مرتب می شدند. در ادامه ی این پژوهش توسط همین گروه ، وابستگی جداسازی به اندازه ذرات و تراکم ذرات در سیال و اثر عدد رینولدز بررسی شده است. در دستگاه ساخته شده امکان جداسازی ذرات تغییر شکل پذیر و جداسازی چندمرحله ای برای دستیابی به خلوص بالاتر نیز وجود دارد. پس از ابداع میکروفلوییدیک اینرسی، دستگاه هایی با هندسه های متنوعی ساخته شده و استفاده می شوند. از مطرح ترین هندسه ها، کانال های حلزونی شکل می باشند. این کانال ها به دلیل هندسه ی ساده ای که دارند، بسیار مورد توجه قرار گرفتهاند. شدت جریان نیز در این کانال ها به دلیل ابعاد نسبتا بزرگ و عدم وجود موانع بالا بوده و امکان ایجاد گرفتگی و انسداد در کانال نیز کاهش می یابد. از دیگر مزیت های این طراحی کانال ها، امکان استفاده از روش های تشخیصی دیگر مانند شاخص های آنتی بادی در دستگاه برای بالا بردن دقت آن است. اخيرا امکان اتصال چندتایی کانال های حلزونی شکل به منظور افزایش شدت جریان ورودی و بالابردن سرعت جداسازی مطرح شده است.
از دیگر هندسه های مطرح در میکروفلوییدیک اینرسی، کانال های مسطح با تغییرات ناگهانی سطح مقطع به واسطه ایجاد انبساط و انقباض ناگهانی در مسیر است. تغییر ناگهانی سطح مقطع باعث انحراف جریان شده و اثری مشابه وجود انحنا در کانال و در نتیجه تشکیل گردابه های دین را می دهد. آرایه های انبساط و انقباض در این کانال ها می تواند به صورت متقارن (مشابه مجموعه ای از اوریفیس های متوالی) یا غیرمتقارن(انبساط و انقباض در یک سمت کانال ) طراحی شوند. سازه های غیر متقارن، پیش از کاربری برای جداسازی ذرات، به عنوان مخلوط کننده و متمرکز کننده ذرات و همچنین جداسازی بخش سلولی خون از پلاسما به کار رفته اند.
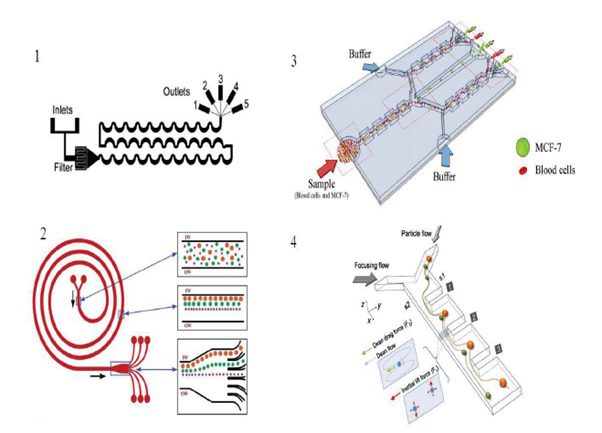
تصویر دستگاه های جداساز اینرسی1-ساختار مارپیچی، 2- ساختار حلزونی، 3-ساختار مولتی اوریفیس، 4-کانال مسطح با انبساط و انقباض مداوم.
شرح پروژه:
در این محصول آموزشی، علاوه بر آموزش ویدیویی شبیه سازی سیستم میکروفلوئیدیک برای جداسازی سلول های گلبول های قرمز خون و پلاکت ها در نرم افزار کامسول، فایل های کامل پروژه(کامسول) و تصاویر مرحله به مرحله از اجرای پروژه و گزارش فارسی پروژه را نیز دریافت خواهید کرد.
مدت فیلم آموزشی 49 دقیقه
**توجه**
**تمامی آموزش های ویدیویی با کیفیت بالا و بدون رکورد صدا توسط پژوهشگران انسیس سی اف دی ضبط شده است**
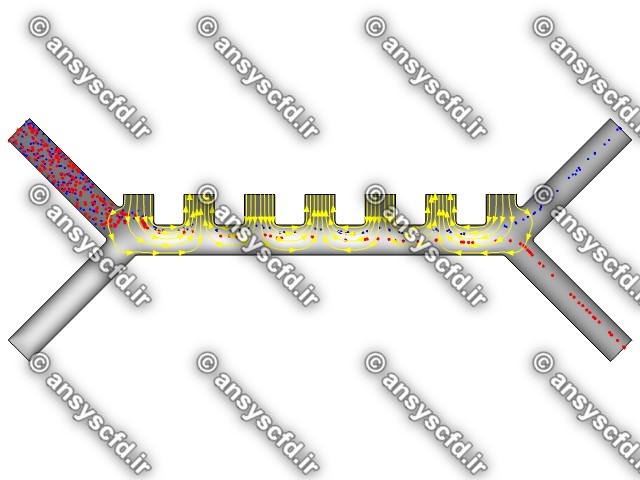
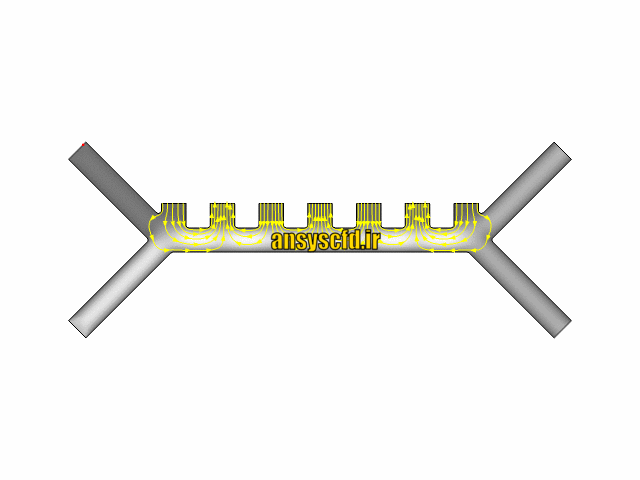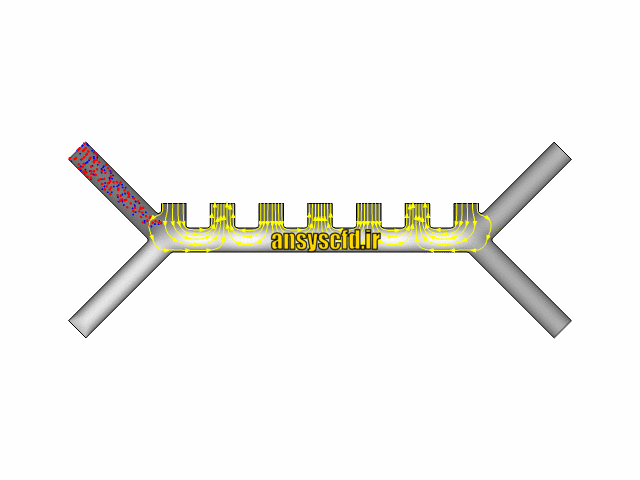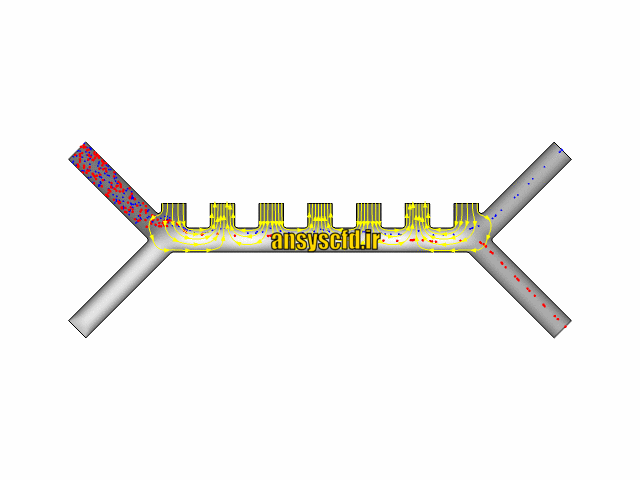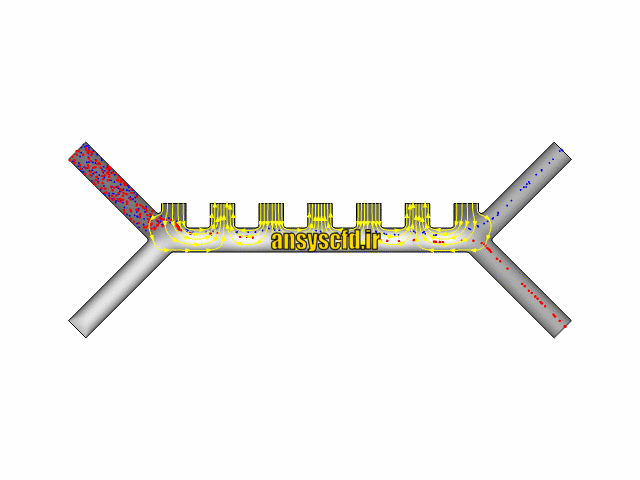
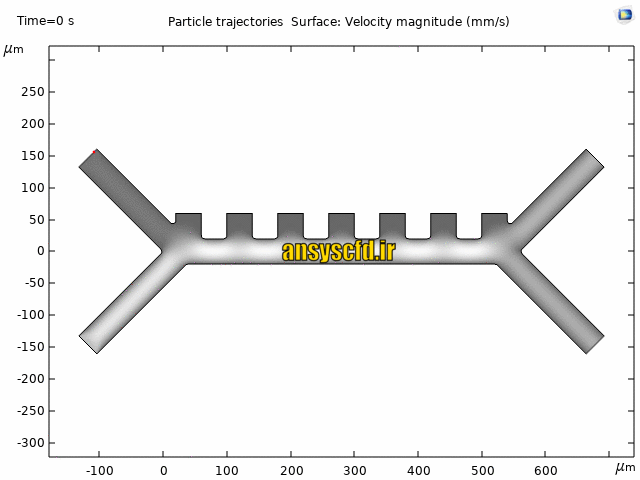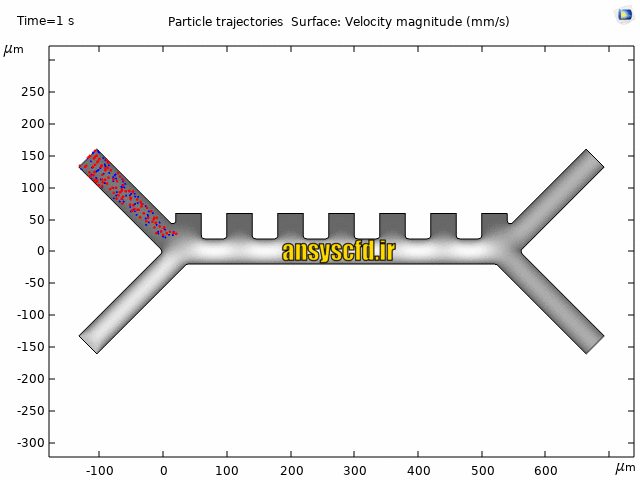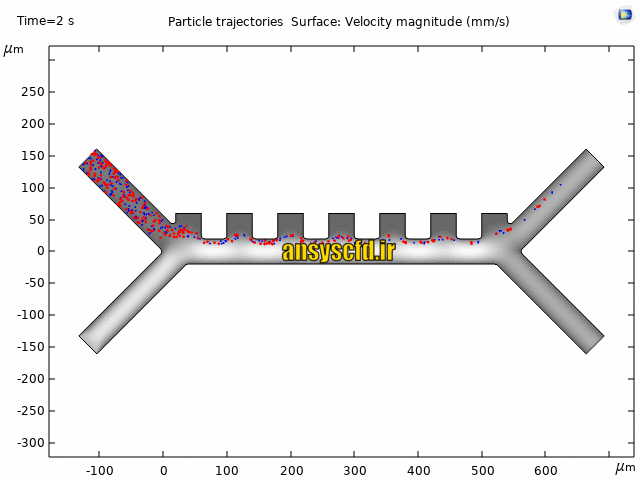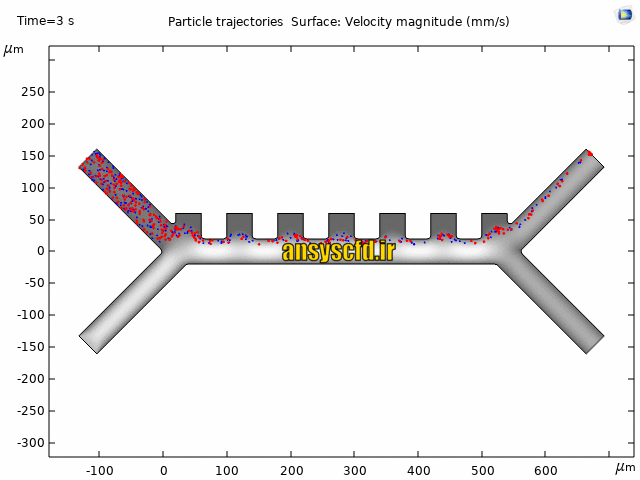
هندسه مسئله:
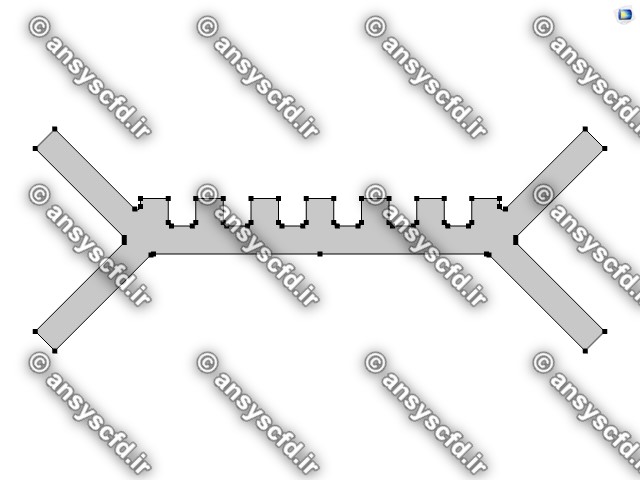
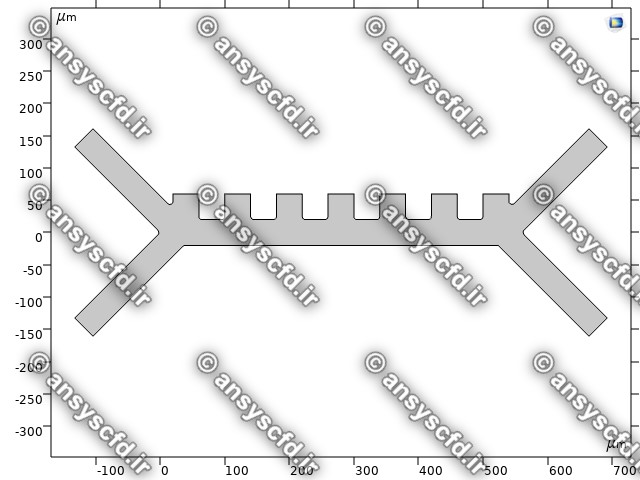
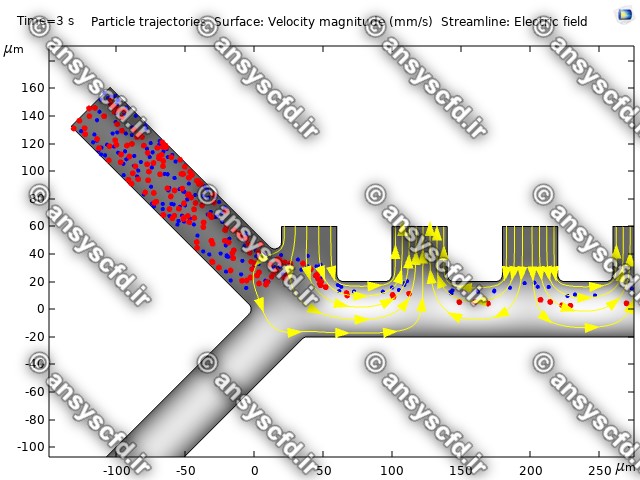
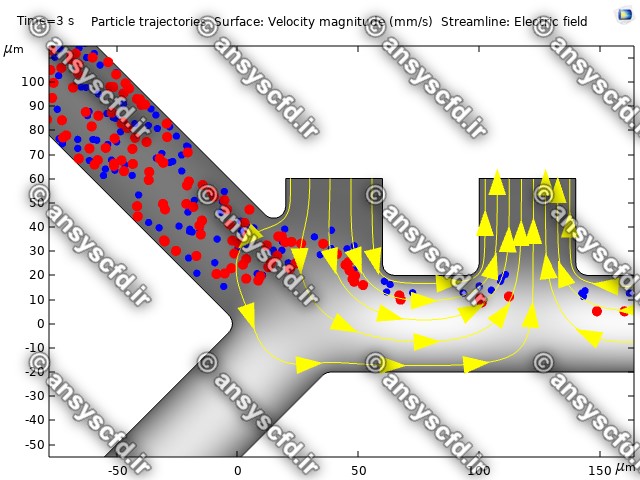
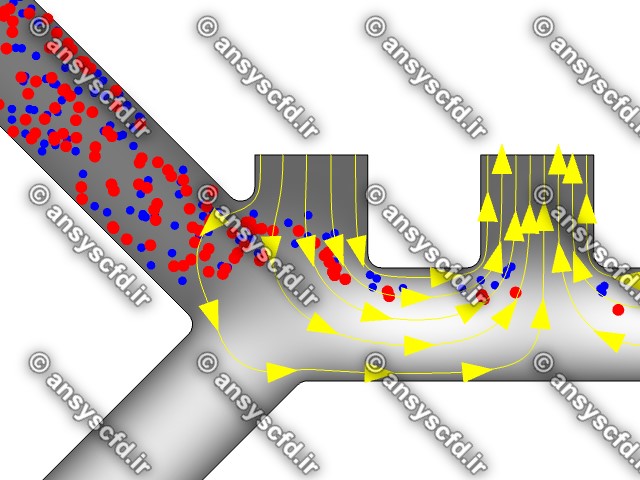
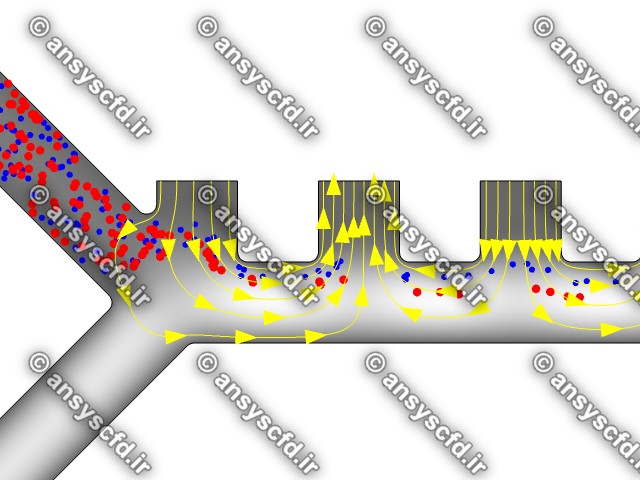
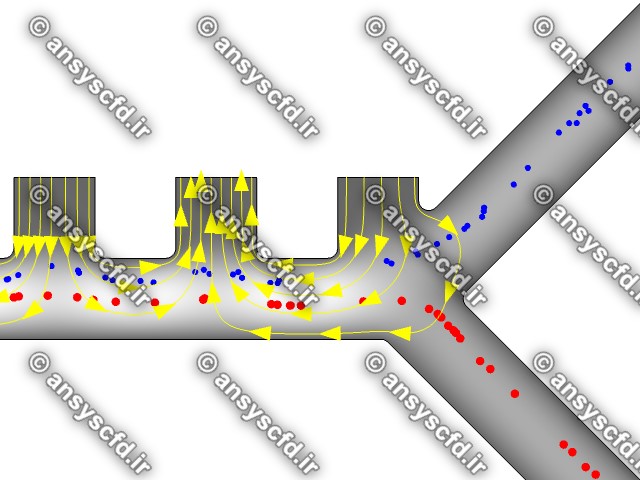
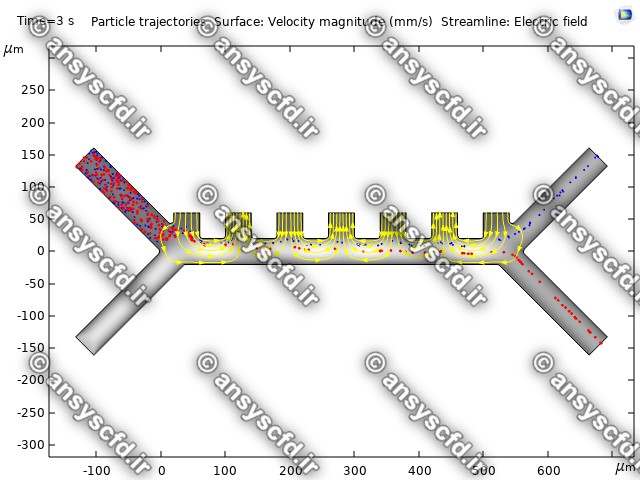
نمونه نتایج:
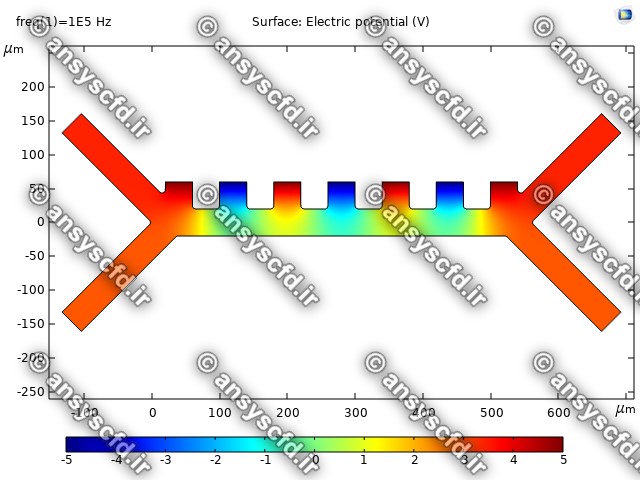
نتایج پتانسیل الکتریکی در کانال میکروفلوئیدیک:
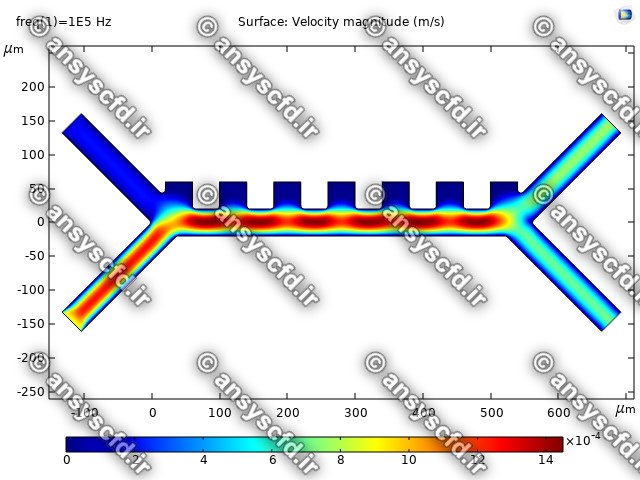
نتایج سرعت:
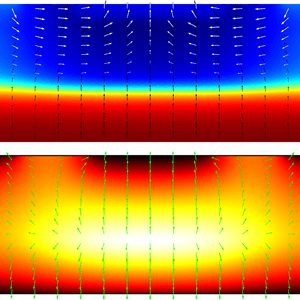
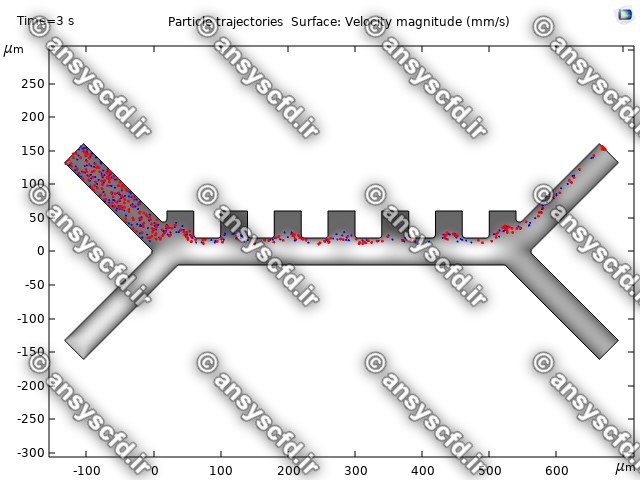
نتایج بدون جداسازی توسط نیروی دی الکتروفورز:
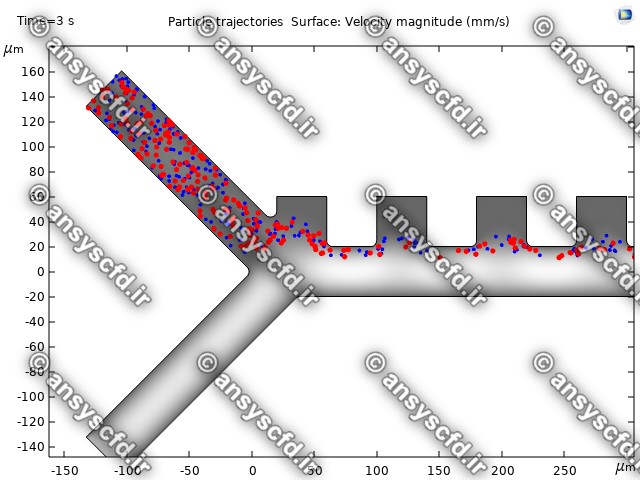
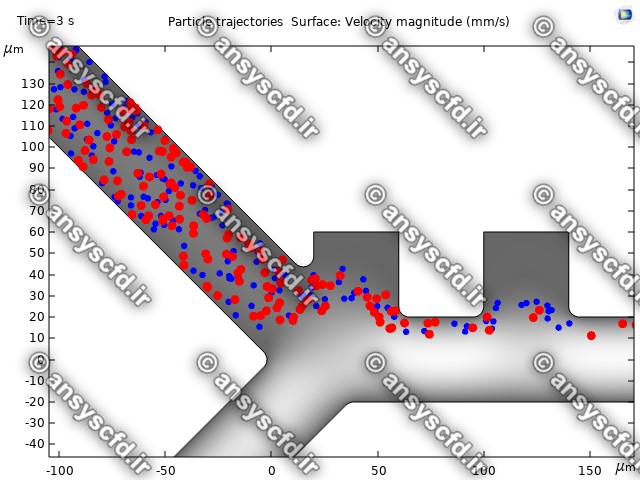
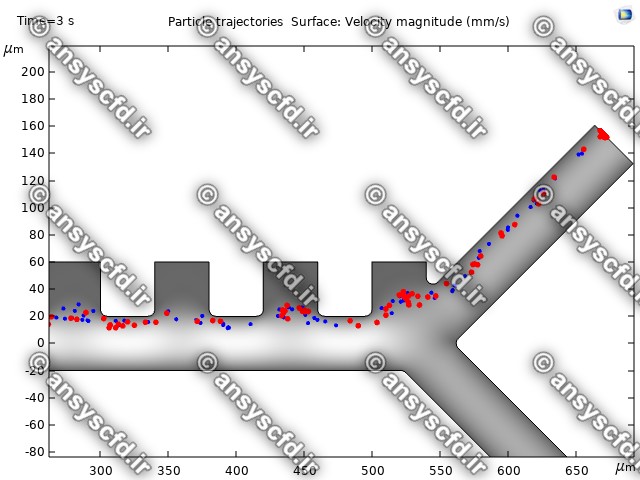
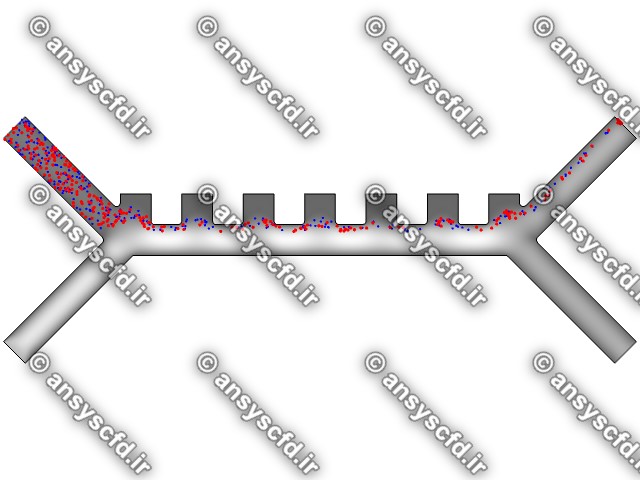
نتایج با کمک جداسازی توسط نیروی الکتروفورز: