توضیحات
پروژه شبیه سازی عملکرد آنتن هم محور تک روزنه در درمان سرطان در بافت کبد به روش هایپرترمیا در کامسول
سرطان از عوامل اصلی مرگ و میر مردم در جهان است. متاسفانه ما در قرنی زندگی می کنیم که تمامی ما انسان ها برای ابتلا به سرطان مستعد شده ایم. سالانه افراد زیادی در اثر ابتلا به انواع سرطان ها فوت میکنند. سرطان سومین عامل مرگ و میر در ایران است؛ با افزایش درصد سالمندی در جمعیت کشور انتظار می رود بروز موارد سرطانی در دو دهه آینده به دو برابر افزایش یابد. در صورت افزایش آگاهی، تشخیص به موقع و درمان مؤثر، بسیاری از مبتلایان به سرطان می توانند از عمری طولانی برخوردار شوند. سرطان به دلیل تغییرات ژنتیکی در سلول ها ایجاد می شود. یک سلول طبیعی معمولا پس از یک سلسله تغییر و تحول در ژن ها، به سلول سرطانی تبدیل می شود. در شرایط عادی سلول ها، در حد نیاز بدن و به صورت کنترل شده، رشد کرده و تقسیم می شوند. زمانی که ژنتیک سلولی تغییر پیدا می کند، سلول به طور غیر قابل کنترلی شروع به تقسیم می کند و سلول های اضافی به وجود می آیند، و اغلب تشکیل توده ای از بافت را می دهند که تومور نامیده می شود. این تومورها می توانند خوش خیم (غیرسرطانی) و یا بدخیم (سرطانی) باشند.
از جمله روش های موثر و مرسوم در درمان سرطان، جراحی، شیمی درمانی و رادیو درمانی است. با توجه به اینکه روش های نام برده، در همه موارد سرطان ها لزوما کارامد نیستند، و از طرفی هر کدام عوارض خاص خود را به وجود می آورند، امروزه روش های دیگری هم برای مقابله با سرطان به کار گرفته می شوند. از آن جمله می توان هایپرترمیا، درمان ایمنولوژیکی، درمان فوتوداینامیک و … را نام برد. هر یک از این روش ها موارد کاربرد خود را دارند، و تشخیص اینکه کدام روش، یا ترکیب کدام روش ها برای یک مورد سرطان مناسب است، توسط گروه پزشکی انجام می شود. در این مطالعه روش هایپرترمیا مورد بحث قرار خواهد گرفت.
هایپرترمیا (hyperthermia):
واژه هایپرترمیا متشکل از دو کلمه “هایپر” به معنی “بالا” و “ترم” به معنی “گرما” است، هایپرترمیا به صورت کلی به معنای افزایش دمای بدن به بیش از میزان طبیعی آن است. دمای بالای بدن به طور معمول باعث بیماری می شود، مثل تب و یا شوک گرمایی، اما افزایش کنترل شده دما در بعضی از موارد برای درمان بیماری ها به ویژه سرطان به کار می رود. گرما درمانی، فرآیندی شامل افزایش دمای بافت های حاوی تومور معمولاً تا بیش از ۴۲ درجه سانتی گراد است و هدف آن از بین بردن سلول های سرطانی است. این فرآیند درمانی به طور معمول با سایر روش های درمان سرطان مثل پرتودرمانی و شیمی درمانی همراه می شود.
توانایی کنترل توزیع انرژی در داخل بافت های زنده با گسترش ابزارهای الکترونیک و سیستم های مدل سازی در دهه های گذشته بسیار مورد توجه بوده و پیشرفت قابل ملاحظه ای داشته است. از هایپرترمیا به دو شکل کلی موضعی و منطقه ای برای درمان سرطان استفاده می شود.
عدم توزيع حرارت در تمامی سلول های توموری، ناکافی بودن مقدار گرمای تولیدی و نیز تیمار حرارتی ناخواسته سلول های سالم، مهمترین چالش های روش های فعلی هایپرترمیا است. نانوفناوری افق های جدیدی را جهت حل این مشکلات پیش روی محققان قرار داده است. نانوذرات با توانایی تجمع اختصاصی در بافت تومور، توزیع در تمام نواحی تومور و همچنین توانایی ایجاد گرمای بیشتر، درمان موثرتری را نوید می دهند. نانوذرات فلزی و نانوذرات مغناطیسی از مهمترین نانوذرات مورد استفاده در هایپرترمیا هستند.
ایده استفاده از گرما برای درمان سرطان برای مدت طولانی مدنظر بوده است، اما تلاش های سالیان اخیر منجر به عملیاتی شدن این ایده شده است. علت اصلی این تاخیر، رسیدن به توانایی ایجاد افزایش دمای مناسب در مکان مناسب است به طوری که باعث آسیب به سلول ها و بافت سالم بدن نشود. امروزه با دستگاه ها و روش های جدید این امر تا حدودی قابل دستیابی شده است. به طور معمول هایپرترمیا به همراه سایر روش های درمان سرطان مانند شیمی درمانی و پرتودرمانی بکار گرفته می شود. به نظر می رسد که هایپرترمیا باعث حساس شدن بیشتر سلول های سرطانی به پرتو و داروهای شیمی درمانی می شود. مطالعات بالینی بسیاری بر روی ترکیب هایپرترمیا و پرتو درمانی و یا شیمی درمانی بر انواع مختلف سرطانها مانند سارکوما، ملانوما ، سرطان سر و گردن، گردن، رکتوم، کبد، سرویکس، مزوتلیوم، پستان، مثانه، ريه، مغز و غیره صورت گرفته است. بسیاری از این مطالعات نشان از اثر هایپرترمیا در کاهش اندازه تومور به عنوان درمان همراه دارند.
اینکه چگونه دمای یک ناحیه خاص از بدن را به بالای دمای سیستمی برسانیم یک چالش تکنیکی و در حال بررسی است. به طور کلی جریان خون مانع افزایش دما می شود و سرعت جریان خون در بافت تومور در حدود ۱۰۰ گرم بر دقیقه است. بنابراین برای رسیدن به دمای بالاتر از ۴۲ درجه سانتی گراد در برخی نواحی توموری بایستی حداقل دانسیته توان W/kg 40-20 در ناحيه هدف بکار گرفته شود.
در حال حاضر مقدار توزیع دمای بهینه برای کاربردهای بالینی هایپرترمیا ناشناخته است. توزیع دمای بدست آمده در روش های مختلف هایپرترمیا دارای همگونی(هموژنیسیته) کم و مقدار کلی گرما تولید شده نیز محدود است. این امر به علت ویژگی های فیزیولوژیکی و فیزیکی مرزهای الکتریکی بافت، متفاوت بودن سرعت و نظم جریان خون در نواحی مختلف و عوامل دیگر است(حداقل اختلاف دما برای درمان های هایپرترمیا به طور معمول در حدود 5.39-5.40 درجه سانتیگراد) است. با پیشرفت های بدست آمده در ابزارها و روش های هایپرترمیا، امروزه در حدود پنجاه درصد از تومورهای عمقی را می توان تا دمای ۴۲ درجه در نقاط خاص گرم کرد. اما با این وجود، رسیدن به دمای مشخص در تومورهای مختلف که دارای کاربردهای بالینی باشد هنوز نامشخص است. بنابراین نیاز به ایجاد دمای بالا و همگن در تومور تا جایی که امکان دارد کماکان وجود دارد.
روش های هایپرترمیا:
از هایپرترمیا به دو شکل کلی برای درمان سرطان استفاده می شود. در روش اول از ایجاد دمای بسیار بالا برای از بین بردن قسمت کوچکی از سلول ها و یا بافتی مانند تومور استفاده می شود. این نوع هایپرترمیا به طور معمول هایپرترمیای موضعی نامیده می شود. در روش دوم دمای قسمتی از بدن و یا حتی کل بدن چند درجه بیشتر از دمای طبیعی بدن بالا برده می شود، این نوع تیمار باعث بهبود عملکرد سایر درمان های سرطان مانند رادیو درمانی و شیمی درمانی می شود. این شکل هایپر ترميا، هایپرترمیای منطقه ای و یا هایپرترمیای کل بدن نامیده می شود. هر دو روش کلی معمولا به عنوان درمان همراه بکار گرفته می شوند. البته در بعضی از مدهای هایپرترمیا مانند تخریب رادیوفرکانس، ممکن است به عنوان درمان اصلی نیز بکار گرفته شود.
هایپرترمیای موضعی(local hyperthermia):
در هایپرترمیای موضعی(و یا تخریب گرمایی microwave ablation) از حرارت برای از بین بردن نواحی کوچک، مثل تومور استفاده می شود. به طور معمول حرارت بسیار بالای بکار گرفته شده باعث تخریب پروتئین های سلول های سرطانی و تخریب عروق مجاور آنها می شود. برای ایجاد چنین حرارتی معمولا از امواج رادیوفرکانس، مایکروویو(microwave)، فراصوت و سایر انواع انرژی استفاده میشود و بسته به موج استفاده شده روش مورد استفاده نامگذاری می شود. به عنوان مثال زمانی که از فراصوت استفاده می شود تکنیک به نام هایفو( HIFU مخفف High intensity focused ultrasound) نام گذاری می شود که در مقایسه با روش هایی که از اپلیکاتورهای آنتن مبدل و یا هر وسیله دیگری که برای تولید انرژی الکترومغناطیس و یا فراصوت، میدان الکتریکی، دیامتری و یا لیزر بکار برود اپلیکاتور Applicator نامیده می شود) الكترومغناطیس استفاده می شود اهمیت کمتری دارند.
هایپرترمیای درون بافتی(Interstitial hyperthermia):
در این روش که در واقع یک نوع هایپرترمیای موضعی محسوب می شود، اپلیکاتور در داخل بافت تومور قرار داده می شود و به طور معمول همراه با براکی تراپی Brachytherapy (روش درمان رادیو درمانی که در آن دانه های کوچک حاوی رادیونوکلویید در ناحیه توموری قرار می شود) بکار گرفته می شود. این تکنیک برای تومورهای با قطر کمتر از ۵ سانتیمتر معمولاً کاربرد دارد اما برای هر تومور قابل دسترسی (مثل تومورهای سر، گردن و پروستات) امکان انجام دارد. از آنتن های مایکروویو، الکترودهای رادیوفرکانس، مبدل های فراصوت(HIFU) و حتی فیبرهای لیزری به عنوان آنتن و یا همان منبع گرما می توان استفاده کرد.
بنابر دلایل فیزیکی، شیب گرادیان توان در اطراف آنتن بسیار بالا است، بنابر این تغییرات گرمایی گسترده ای وجود دارد. به همین دلیل نیاز به قراردهی آنتن های متعدد در فواصل ۱ تا 1.5 سانتی متری از یکدیگر در بافت تومور وجود دارد، که هم بسیار تهاجمی است و نیز ممکن است به علت حساسیت آنتن های مایکرویو به تداخل موجی با مشکل مواجه شود، بنابراین نیازمند دقت بالاست. متاسفانه حتی با بکارگیری تعداد زیاد اپلیکاتور باز هم رسیدن به توزیع دمای همگون در تمام بافت تومور تقریبا غیر قابل دسترس است.
هایپرترمیای داخل حفره ای:
در این روش از حفره ها و یا مدخل های طبیعی بدن مثل پیشابراه (درمان پروستات)، رکتوم(راست روده)، واژن، سرویکس (دهانه رحم) و مری استفاده می شود. این روش دارای همان اصول فیزیکی روش درون بافتی است ولی از الکترودهایی با اندازه سانتی متر استفاده می کند(که باعث عمق نفوذ بیشتر می شود).
هایپرترمیای ناحیه ای و یا هایپرترمیای قسمتی از بدن:
تومورهای عمقی به عنوان مثال در لگن و یا در حفره شکمی را می توان توسط آرایه ای از آنتن ها گرم کرد. توزیع دما و دانسیته توان این نوع هایپرترمیا بسته به تیمارهای مختلف قابل تغییر است. البته محدودیت هایی در توزیع کمیت آهنگ جذب انرژی(SAR) وجود دارد. کمیت آهنگ جذب انرژی(SAR مخفف specific absorption rate) ، کمیتی است که بیانگر میزان جذب انرژی امواج در بدن است و مستقیما می تواند شدت تأثیرگذاری گرمایی آنها را نشان دهد. به بیان دیگر هر چه SAR بیشتر باشد، میزان تأثیر گرمایی امواج الکترومغناطیس بیشتر خواهد بود. واحد SAR وات بر کیلوگرم است تولیدی وجود دارد. محاسبات مدل سازی نشان داده است که با افزایش تعداد جفت آنتنها توزیع توان، قابل کنترل تر است.
هایپرترمیای تمام بدن:
در سرطان های همراه با متاستاز، می توان از دمای ثابت ۴۲ درجه سانتی گراد برای ۱ ساعت استفاده کرد. عوارض ایجاد شده از این درمان قابل قبول است، ولی چنین درمانی بایستی تحت درمان مسکن، آرام بخش و یا حتی بیهوشی عمومی باشد. روش های مانند استفاده از تب زاها و گرمادهی مستقیم به خاطر ایجاد اثرات سمی و محدودیت های عملکردی کنار گذاشته شده اند و امروزه تنها از سیستم های تابشی به همراه دورره های تیمار تابش ۶۰ و ۹۰ دقیقه ای استفاده می شود.
شرح پروژه:
در این پروژه به برسی و تحلیل انتقال حرارت در بافت کبد توسط هایپرترمیا به وسیله امواج مایکروویو با استفاده از آنتن تک روزنه پرداخته شده است. در این پروژه از نرم افزار کامسول Comsol استفاده شده است.
مدلسازی انتقال حرارت زیستی یا بیوهیت(Bioheat):
قدیمی ترین و تاثیر گذارترین پژوهش انجام شده در انتقال حرارت زیستی(بیوهیت)، توسط پنس(۱۹۴۸) انجام شده است. در این مطالعه پنس به بررسی توزیع دما در بازوی یک انسان (در وضعیت آرام)، می پردازد. براساس آزمایش های انجام شده در مطالعه پنس، پنس مدلی برای شبیه سازی توزیع دما در بافت دارای سیستم خون رسانی ارائه می کند. معادله حاکم بر این مدل در مختصات دکارتی دو بعدی عبارت است از:
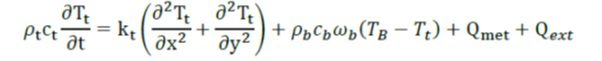
در این معادله ρ، c، k، wb ، T، Qext و Qmet به ترتیب چگالی، گرمای ویژه، ضریب هدایت، نرخ پرفیوژن، دما، نرخ تولید حرارت توسط منبع خارجی و نرخ تولید حرارت متابولیک در بافت می باشند. TB دمای شریانی و ثابت فرض می شود. زیرنویس های t و b هم به ترتیب مربوط به بافت و خون می باشند.
جمله ![]() در این معادله برای شبیه سازی اثر رگ های خونی موجود در بافت اعمال شده است. در واقع پنس اثر رگ های خونی را به صورت یک چشمه یا چاه حرارتی در نظر گرفته است. مهمترین انتقادهایی که به مدل پنس وارد می شود، مربوط به همین مساله است. در واقع پژوهشهای بعدی ثابت کرد، نحوه مدل سازی شبکه خون رسانی در مدل پنس فقط در بعضی شرایط خاص به واقعیت نزدیک است. این مدل فقط اثر شبکه مویرگی را به خوبی شبیه سازی می کند. تولید حرارت متابولیک و حرارت تولیدی توسط منبع خارجی هم به صورت جملات چشمه حرارتی در معادله پنس اعمال شده، که می تواند ثابت یا دارای یک توزیع مشخص باشد.
در این معادله برای شبیه سازی اثر رگ های خونی موجود در بافت اعمال شده است. در واقع پنس اثر رگ های خونی را به صورت یک چشمه یا چاه حرارتی در نظر گرفته است. مهمترین انتقادهایی که به مدل پنس وارد می شود، مربوط به همین مساله است. در واقع پژوهشهای بعدی ثابت کرد، نحوه مدل سازی شبکه خون رسانی در مدل پنس فقط در بعضی شرایط خاص به واقعیت نزدیک است. این مدل فقط اثر شبکه مویرگی را به خوبی شبیه سازی می کند. تولید حرارت متابولیک و حرارت تولیدی توسط منبع خارجی هم به صورت جملات چشمه حرارتی در معادله پنس اعمال شده، که می تواند ثابت یا دارای یک توزیع مشخص باشد.
مدل سازی انتقال حرارت زیستی(بیوهیت) شامل گسترش مدل ها برای تحلیل و بررسی انتقال گرما در مواد (مانند بافت ها ، مایعات) و سیستم های مربوط به ارگان های زنده می باشد. حل معادله انتقال حرارت زیستی که به مدل های خاصی اعمال می شود از اهمیت ویژه ای برخوردار است، بدیهی است این مدل ها برای کشف تکنیک های بالقوه برای کاربردهای درمانی حساس(به عنوان مثال، از بین بردن سلول های سرطانی، کشتن تومورها)، توسعه یافته اند.
در ماه آگوست ۱۹۴۸، هری پنس مقاله خود با عنوان “تحلیل و بررسی بافت و دماهای خون شاهرگی در بازوی انسان در حال استراحت” را منتشر ساخت. او در مقاله خود پیشنهاد کرد که جریان گرما با اختلاف دمای بین خون شاهرگی و دمای بافت محلی متناسب می باشد. پژوهش های پنس در مطالعه ما مورد توجه بوده و در محیط نرم افزار کاربردهای اساسی دارد.
در نرم افزار COMSOL، معادله انتقال حرارت زیستی یا بیوهیت (معادله پنس) به شکل یک حالت برنامه درون ماژول انتقال حرارت قرار می گیرد. در این حالت فرم معادله انتقال حرارت زیستی بصورت زیر فرمولسازی می شود:
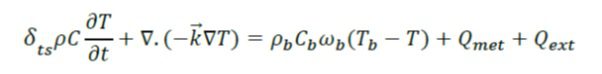
میزان پرفیوژن مقداری است که مایع (مانند خون) در سراسر یک نوع خاص از بافت جریان دارد که نوع بافت (مانند ماهیچه، قلب و کبد) و سیال در این فرایند بسیار اهمیت دارد.
با وجود به اینکه این معادله برای جریان خون فرمول سازی شده است، از آن می توان برای سیالات و ترکیبات مایع دیگر (مانند خون مصنوعی و سیالات مختلف موجود در بدن حیوانات زنده) تحت شرایط مناسب استفاده کرد.
معادله انتقال حرارت زیستی شبیه به معادله انتقال حرارت هدایت می باشد. در شرایطی که در انتقال حرارت حالت پایا، اولین ترم سمت چپ در معادله فوق صفر در نظر گرفته شود.
![]()
در معادله انتقال حرارت زیستی، تنها ترم منبع گرمایی(Q) در سمت چپ معادله انتقال حرارت هدایتی به سه ترم تقسیم می گردد:
-ترم پرفیوژن![]()
ترم گرمای متابولیکQmet
ترم منبع گرمای خارجی Qext
هدف از تقسیم تنها منبع حرارتی معادله انتقال حرارت زیستی به سه ترم گرمایی به منظور سهولت فرمول بندی و همچنین تبدیل کردن فرم معادله به فرم معادلات PDE است. از این فرم معادله می توان زمانی که مدلسازی زیستی ایجاد می شود استفاده کرد. معادله انتقال حرارت زیستی که توسط پنس ساخته شده، یک تقریب مرتبه اول مناسب برای حل مسایل انتقال حرارت زیستی است.
تابش لیزر در تومور:
ضریب نوری جذب فوتون های لیزری(تشعشع) برای تومورها بطور کلی تفاوت قابل توجهی با ضریب نوری جذب برای بافت اطراف ندارد. به منظور توسعه این متدولوژی درمانی(تشعشع لیزری)، لازم است ضریب جذب محلی را با ابزار مصنوعی بالا برد. تغییر در ضریب جذب با استفاده از تزریق مواد با خواص جذب بالا در تومور انجام می گردد. این روش معمولاً بعنوان یک روش تهاجمی خفیف طراحی می گردد.
انرژی اشعه لیزر که به عنوان یک منبع گرمایی برای معادله انتقال حرارت زیستی است بصورت زیر می باشد:
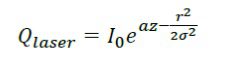
که :
I0 = شدت تابش (W/m2)
a = میزان جذب(l/m)
σ = عرض ناحیه تابش داده شده(m).
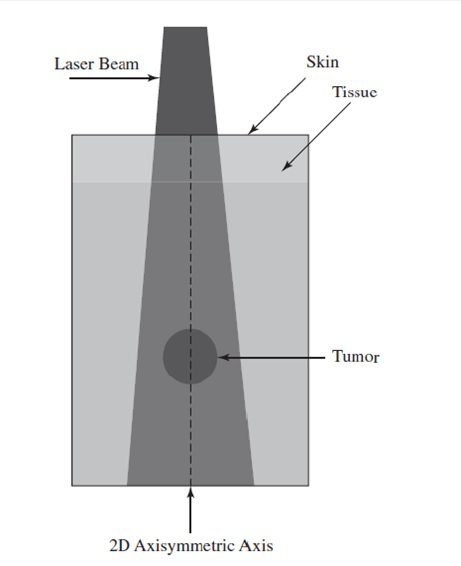
شکل بازبینی ناحیه مدلسازی مدل انتقال حرارت زیستی.
انواع آنتن مایکروویو:
هایپرترمیا تکنیک سوزاندن بافت تومور با استفاده از مایکروویو در بدن میباشد. در حقیقت مشابه با مایکروویوهای خانگی که به منظور گرم و طبخ غذا استفاده می شود و همان انرژی را بوسیله آنتن های مخصوصی که در ضایعه قرار می گیرد به تومور منتقل می کند. در این روش همانند شکل زیر آنتن های مخصوص(سوزن های مایکروویو) با هدایت سی تی اسکن وارد تومور شده و با اتصال به دستگاه مولد مایکروویو و ایجاد حرارت سلول های زنده در محل سوزانده می شوند.
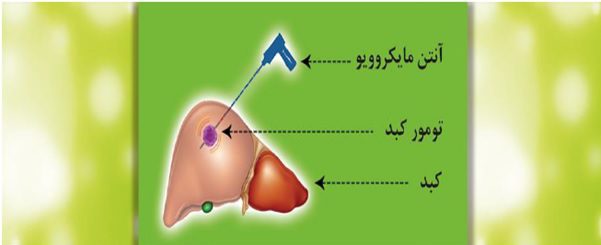
شکل درمان تومور در کبد با آنتن مایکروویو.
از این رو انواع مختلفی از آنتن ها طراحی شده اند که عبارتند از: آنتن های روزنه ای، آنتن های یکپارچه(Monopole antenna)، آنتن های دوقطبی(Dipole antenna)، آنتن های سه محوری(Triaxial antenna) و آنتن های مسدود شده(Choked antenna). در شکل زیر این نوع آنتن ها نشان داده شده است.

شکل انواع آنتن های مایکروویو.
نرم افزار کامسول:
شبیه سازی های رایانه ای یکی از ارکان اساسی پیشبرد علوم مختلف در حوزه های فنی مهندسی و نیز علوم پایه به شمار می آیند که نقش موثری در تحلیل مسایل و بررسی ایده های نوین ارایه شده در هر شاخه از علوم روز را بر عهده دارند. امروزه، تخصصی شدن دانش در هر یک از زمینه های علمی و فنی نیازمند به روزشدن نرم افزارهای برنامه نویسی و شبیه سازی در حوزه مربوطه است. در چند سال گذشته با توسعه ی بسته های مبتنی بر روش های عددی، مانند روشهای تفاضل محدود حوزهی زمان و فرکانس و نیز روشهای المان محدود، شاهد گسترش نرم افزارهای تخصصی در هر یک از زمینه های فنی و مهندسی و علوم پایه بوده ایم. البته باید گفت تعداد نرم افزارهایی که قادرند پدیده های مختلف فیزیکی در حیطه های مختلف دانش را با یکدیگر ادغام کرده و به تحلیل یک مساله چند فیزیکی بپردازند، به اندازه ی انگشتان یک دست نیز نمی رسند. برای توضیح بیشتر، به این مثال توجه کنید؛ در طبیعت انتقال جریان الکتریکی، بیشتر با افزایش دمای محیط همراه است. برای نشان دادن تاثیر عبور جریان بر نحوه انتشار حرارت و توزیع آن در محیط دو پدیده فیزیکی جریان الکتریکی و توزیع حرارت باید همراه هم و هم زمان تحلیل شوند.
نرم افزار کامسول( COMSOL ) که در این پژوهش از آن استفاده شده است، یکی از این نرم افزارها است. هسته اصلی این نرم افزار که مبتنی بر روش های عددی المان های محدود است، می تواند چند مدل مختلف فیزیکی را در قالب یک پروژه و به صورت همزمان مورد تحلیل قرار دهد. از این رو به راحتی می توان پیشبینی کرد که این نرم افزار، توانایی تحلیل مسایل بسیار تخصصی در هر یک از زمینه های مختلف فنی و پایه نظیر مسایل حیطه مهندسی برق، نانو فناوری، مکانیک جامدات و سیالات، مواد، عمران، اپتیک و فتونیک و نیز مسایل علوم پایه مانند ریاضی، فیزیک و شیمی را دار است.
روش المان محدود:
ایدة اصلی روش المان محدود، جایگزینی یک مساله غیرقابل حل به روش های دقیق و تحلیلی با مثال های ساده تر و با هدف یافتن پاسخی تقریبی است. اگر چه ایده کلی این روش، شناخته شده و به نسبت قدیمی است، اما این روش از سال 1956 برای تحلیل مسایل گوناگون و به شکل امروزی مورد استفاده قرار گرفته است. روش محاسبه FEM با تقسیم هندسه مساله به چندین بخش آغاز می گردد. این مرحله فرایند مشبندی نامیده می شود. طبق شکل زیر زیربخش ها یا عناصر آن دارای اشکال ساده هندسی مانند مثلث، چهار ضلعی و شش ضلعی می باشند.
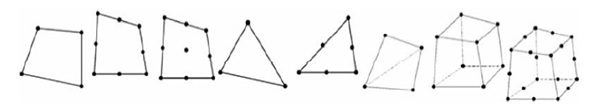
شکل مثال هایی از عناصر شبکه ای و گره های دو بعدی و سه بعدی.
مدل سازی:
حرارت الكترومغناطیس در طیف گسترده ای از مسائل مهندسی نمودار می گردد و متناسب با مدلسازی در COMSOL می باشد. در مدل سازی این پژوهش میدان الکترومغناطیسی با معادله انتقال حرارت زیستی کوپل شده است. در روش هایپرترمی سرطان با استفاده از حرارت موضعی در بافت تومور که اغلب در ترکیب با شیمی درمانی یا رادیوگرافی انجام میگیرد درمان می گردد. یکی از چالشهای مربوط به این روش حرارتدهی عمیق به تومورها بدون آسیب دیدگی بافت های اطراف تومور است که شامل:
-کنترل میزان حرارت دهی و توزیع فضایی
– طراحی و موضع گیری سنسورهای دمایی
در میان تکنیک های گرمایی ممکن، رادیو فرکانس و حرارت دهی مایکروویو توجه زیاد محققان بالینی را جلب کرده اند. درمان مایکروویو با روش انعقاد، نوعی تکنیک در این زمینه است که یک آنتن نازک مایکروویو داخل تومور وارد میشود. آنتن مایکروویو تومور را گرم کرده و یک منطقه لختگی بوجود می آورند که در آن سلول های سرطانی کشته می شوند.
در این مدل، توزیع دما، توزيع تشعشع و نرخ جذب ویژه(SAR) (نسبت مقدار حرارت جذب شده به غلظت بافت) در بافت کبد، زمانی که از یک آنتن تک روزنه هم محور در درمان هایپرترمی استفاده می شود، بدست آمده است. این مدل سازی نیاز به ماژول رادیوفرکانس و ماژول انتقال حرارت بصورت همزمان دارد.
تعریف مدل:
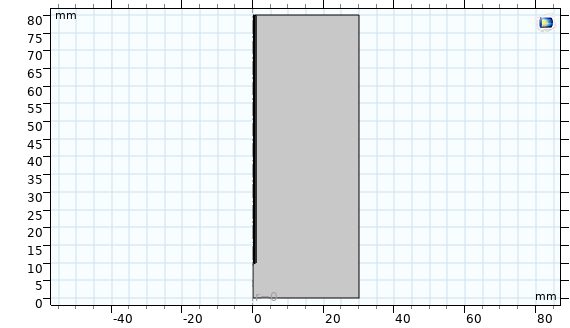
شکل زیر هندسه آنتن مورد نظر را نشان می دهد. جدول های زیر ابعاد و خواص مواد مربوط به آنتن را نشان می دهند.
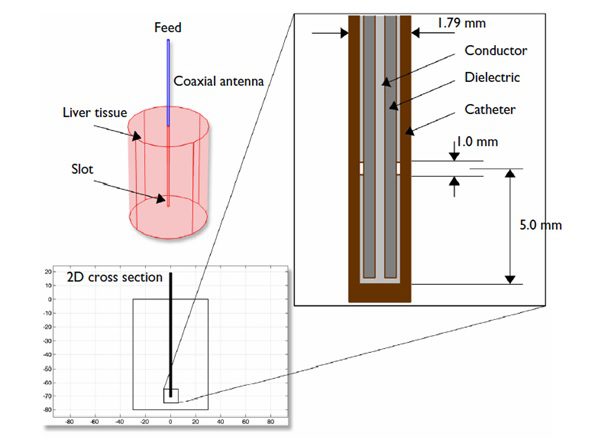
شکل مدل هندسی.
جدول ابعاد آنتن روزنه ای محوری.

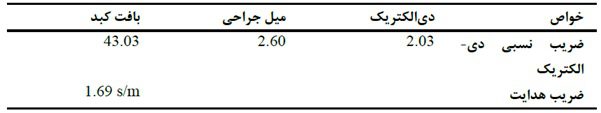
جدول خواص مواد.
مدل مورد نظر این برتری را دارد که یک مساله متقارن چرخشی است، که اجازه می دهد از مدل سازی در مختصات استوانه ای دو بعدی استفاده شود. زمانی که مدل سازی در دو بعد انجام می شود امکان انتخاب مش مناسب و به دنبال آن دستیابی به دقت عالی در جواب نهایی وجود دارد.
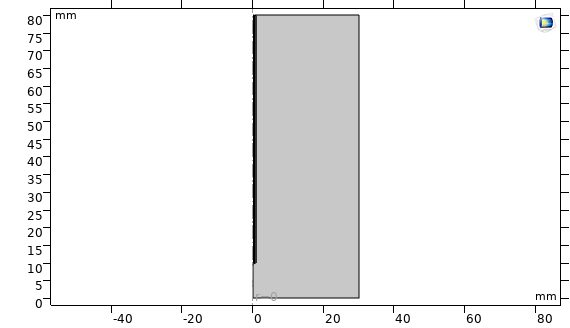
شکل ناحیه محاسباتی که به شکل مستطیل در صفحه rz است.
معادلات مرزی و ناحیه ای الکترومغناطیس:
اشاعه یک موج الکترومغناطیس(E) در یک کابل هم محور توسط میدان های الکترومغناطیس(H) عرضی مشخص می گردد. معادلات متناسب با امواج الکترومغناطیس به قرار زیرند:
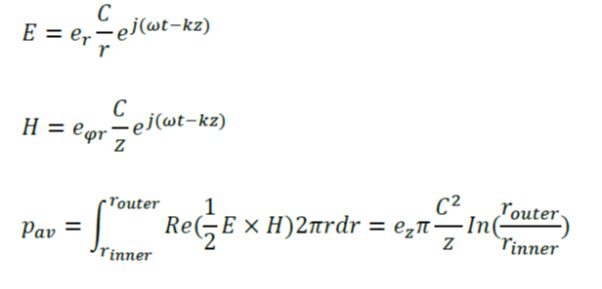
مشخصه z نشان دهنده جهت اشاعه امواج است، r و φ و z مختصات استوانه ای در مرکز محور کابل محوری هستند. Pav میانگین زمانی است که منبع انرژی در کابل جریان دارد، Z مقاومت ظاهری موج در دی الکتریک است، C ظرفيت حرارتی ویژه است، در حالیکه router و rinner شعاع خارجی و شعاع داخلی دی الکتریک هستند. به علاوه ω فرکانس زاویه ای را نشان می دهد. k که ثابت پخش امواج است با طول موج λ، رابطه دارد به فرم زیر است:
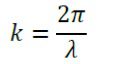
در بافت، میدان الکتریکی یک جزء محوری محدود دارد در جاییکه میدان مغناطیسی صرفاً یک مولفه جهتی است. بنابراین می توان آنتن را با استفاده از فرمول بندی مغناطیسی محوری مدل کرد. پس معادله موج به صورت برداری می شود:
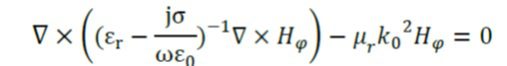
εr ضریب دی الکتریک، ε0 ثابت دی الکتریک بر فاصله، σ ضریب هدایت، μr ضریب نفوذ پذیری، k0 ثابت انتشار موج بر فاصله و Hφ تغذیه میدان مغناطیسی است.
شرایط مرزی برای سطوح فلزی شامل موارد زیر می شود:
![]()
در 0=r شرایط تقارن محوری اعمال می شود:
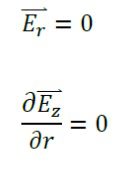
نقطه تغذیه با استفاده از شرایط مرزی مدل سازی میشود و مقدار قدرت آن ۱۰ وات در نظر گرفته شده است.
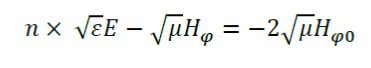
در جایی که تغذیه میدان مغناطیسی بر فاصله (Hφ0) از رابطه زیر بدست می آید:
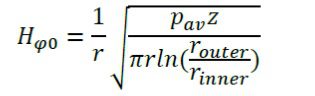
رسانندگی الکتریکی در کبد (σliver) با استفاده از رابطه زیر بدست می آید:
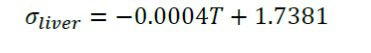
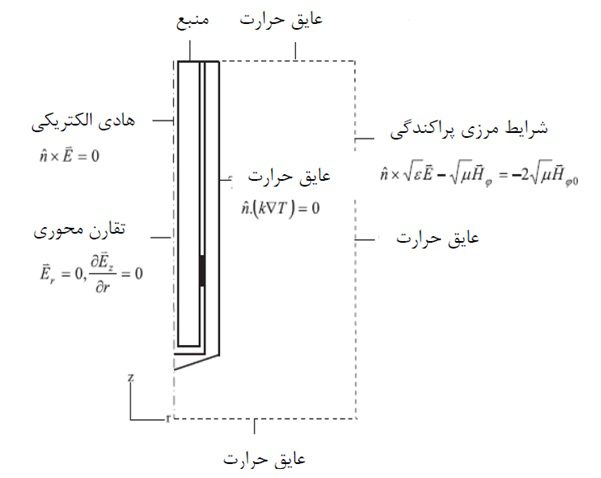
شکل شرایط مرزی اعمال شده.
معادلات مرزی و ناحیه ای انتقال گرما:
معادله انتقال حرارت زیستی(بیوهیت)، مساله انتقال حرارت وابسته به زمان را به شکل زیر توصیف میکند:
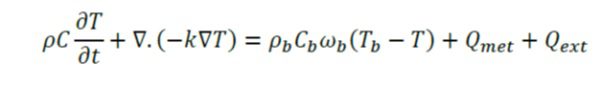
این مدل از منبع حرارتی ناشی از متابولیسم صرف نظر می کند. منبع حرارت خارجی با حرارت مقاومتی تولید شده توسط میدان اکترومغناطیس برابر است:
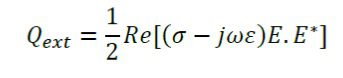
مدل فرض بر آن دارد که میزان پرفیوژن خون برابر با S-1 0.0036 باشد. همچنین خون در دمای بدن C 37= Tb وارد کبد می شود و تا دمایT گرم می شود. ظرفیت گرمای ویژه خون استCb=3639 J/(Kg.K).
برای یک مدل واقعی ممکن است ωb به تابعی از دما باشد. حداقل برای اجزای خارجی بدن مانند دست و پاها مشاهده می گردد که افزایش دما منجر به افزایش گردش خون می شود.
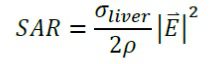
در این مدل چون مدل سازی در کبد صورت گرفته پس از شرایط ایزوله استفاده می شود.
![]()
علاوه بر معادله انتقال گرما، این مدل، انتگرال بافت آسیب دیده را محاسبه می کند:
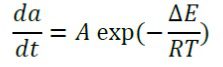
که a درجه آسیب بافت، A فاکتور فرکانس، پارامتر R ثابت جهانی گازها با مقدار Kj/kmolk 8.314 میباشد و ΔE انرژی فعالسازی برای عکس العمل آسیب یک طرفه است (J/mol). این دو پارامتر به نوع بافت وابسته می باشند. کسر بافت تخریب شده (θd) بصورت زیر بیان می گردد.
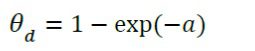
مدل سازی در نرم افزار کامسول:
در این بخش خلاصه ای از نحوه مدل سازی آنتن روزنه ای مورد استفاده در هایپرترمیا به روش مایکروویو در نرم افزار کامسول آورده شده است که در نهایت نمودارهای توزیع دما، نمودارهای کسر بافت های تخریب شده و … استخراج شده است. مساله بصورت دو بعدی متقارن محوری (2D Axisymmetric) حل شده است و فیزیک مساله رادیوفرکانسی (Radio Frequency) و بیوهيت(Bioheat) بصورت همزمان در نظر گرفته شده است. سپس هندسه شکل ترسیم شده است. هندسه شكل شامل ۴ قسمت می شود: ۱- بافت زنده 2- میل جراحی(Catheter )، 3-دی الکتریک( Dielectric )، 4- هوا.
شکل هندسه مدل:
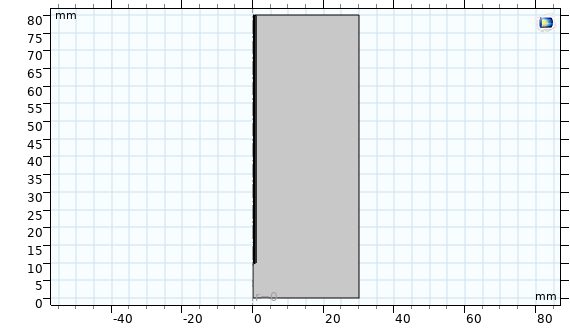
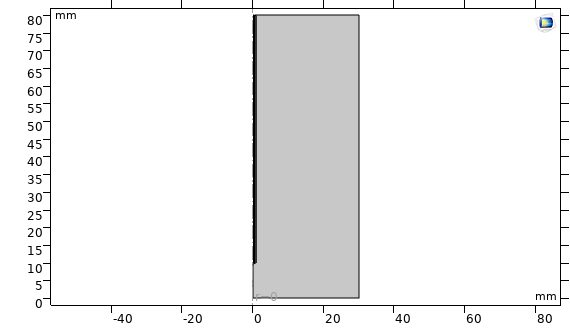
پارامترها:
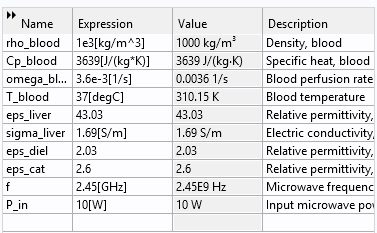
مش زنی:
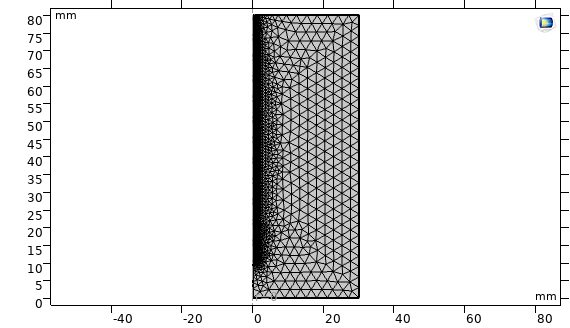
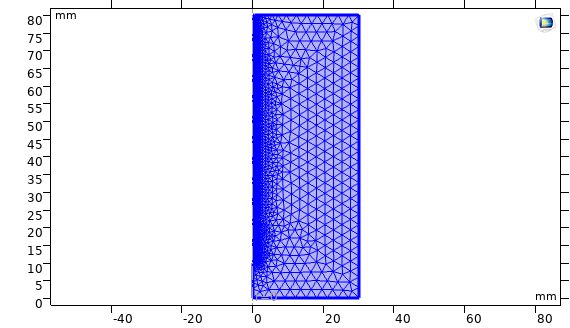
در مرحله مش زدن، مش بصورت Free Triangular در نظر گرفته شده است.
شکل مدل پس از مش زنی.
در شکل زیر نمودار استقلال از مش نشان داده شده است. این نمودار دمای کبد را بر اساس زمان در تعداد مش های مختلف نشان داده است. همانطور که مشخص است حل زمانی مستقل از تعداد مش است که حداقل تعداد مش ۱۱۶۱۰ باشد.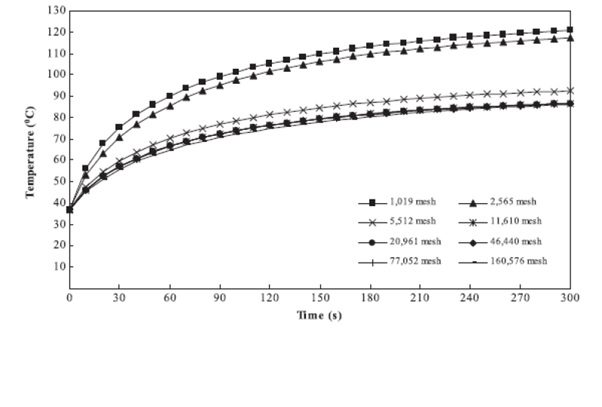
شکل رابطه بین دما و زمان برای تعداد مش های مختلف.
در قسمت حل مساله(Study)، مساله در مرحله اول بصورت Frequency Domain و در مرحله بعد بصورت TimeDependent حل شده است. سپس نمودارهای مورد نیاز استخراج شده است. یکی از مهم ترین این نمودارها، نمودار توزیع شدت گرمای ناحیه ای است.
شکل نمودار توزیع شدت گرما:
نتایج:
نتایج مایکروویو جذب شده:
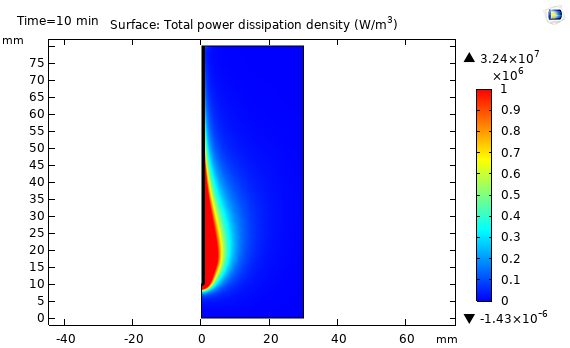
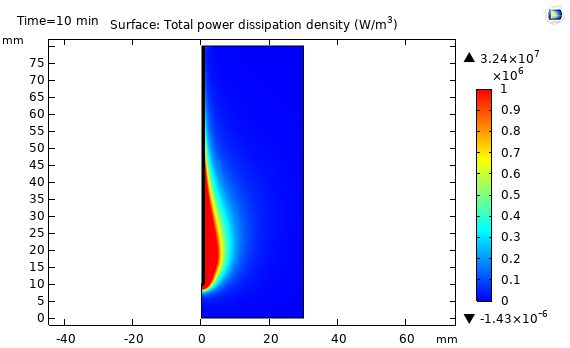
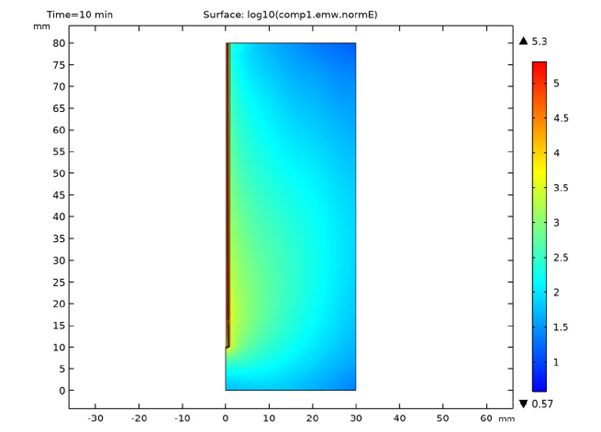
در شکل زیر نتایج شبیه سازی مایکروویو جذب شده در بافت کبد را نشان می دهد. مقدار مایکروویو جذب شده در بافت کبد براساس فرکانس 2.45 GHz و مقدار مایکروویو W 10 می باشد. انرژی مایکروویو توسط آنتن هم محور تک روزنه داخل بافت کبد پخش می شود که توسط دی الکتریک به گرما تبدیل می شود. توزیع مقدار مایکروویو جذب شده در اطراف روزنه تقریباً حالت بیضوی دارد وبیشترین مقدار آن در کنار روزنه آنتن می باشد که هرچه از روزنه فاصله می گیریم این مقدار کاهش می یابد.
نتایج توزیع دما:
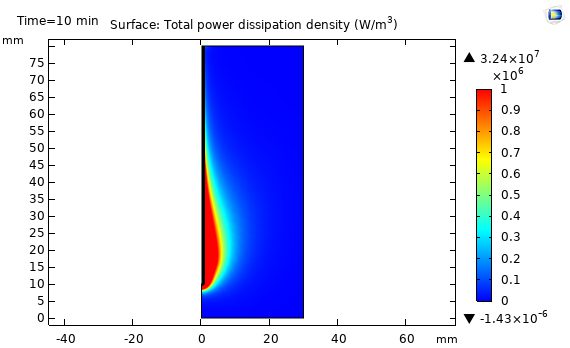
اصل اساسی در درمان مایکروویو اعمال انرژی مایکروویو در بافت کبد توسط آنتن هم محور روزنه ای است. انرژی مایکروویو توسط بافت کبد جذب می شود و بافت را گرم می کند. بافت کبد بعد از اینکه به اندازه دمای کافی و مدت زمان لازم گرم شود تخریب می شود. هدف نهایی در پروسه درمان مایکروویو کشتن سلول های سرطانی بافت کبد است درحالیکه به بافت های سالم کبد آسیبی وارد نشود.
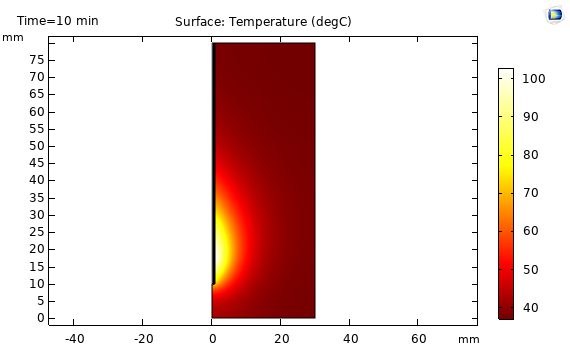
در شکل زیر نتایج شبیه سازی توزیع دما در بافت کبد را نشان می دهد. در این شکل توزیع دما در بافت کبد براساس فرکانس GHz 2.45 و مقدار مایکروویو W 10 نشان داده شده است. مطابق شکل توزیع دما در اطراف روزنه تقریباً حالت بیضوی دارد و بیشترین مقدار آن در کنار روزنه آنتن می باشد که هرچه از روزنه فاصله می گیریم این مقدار کاهش می یابد که مطابق با مقدار مایکروویو جذب شده در بافت کبد است.
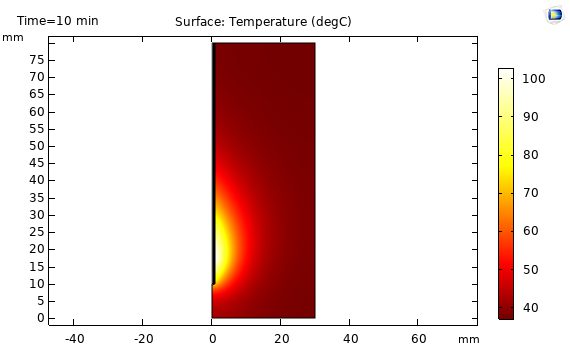
نتایج توزیع کسر بافت های تخریب شده:
در شکل زیر توزیع کسر بافت های تخریب شده نشان داده شده است. این توزیع همخوانی خوبی با توزیع دما در بافت دارد.
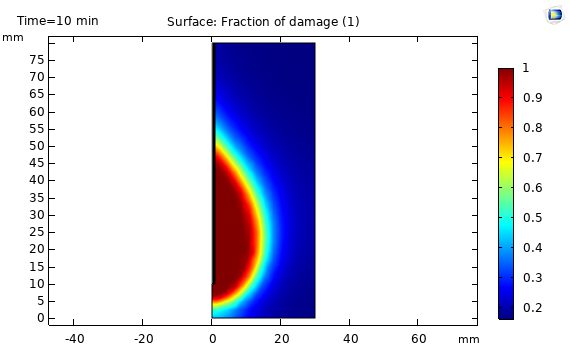
نتایج نمودار کسر بافت آسیب دیده:
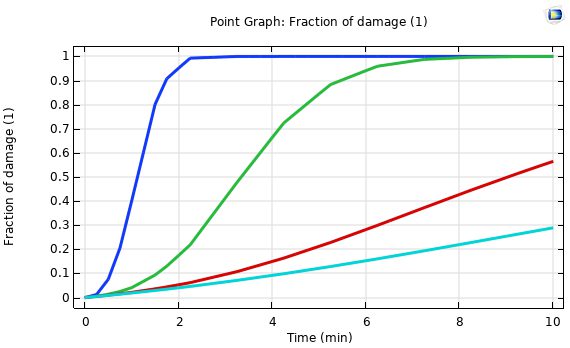
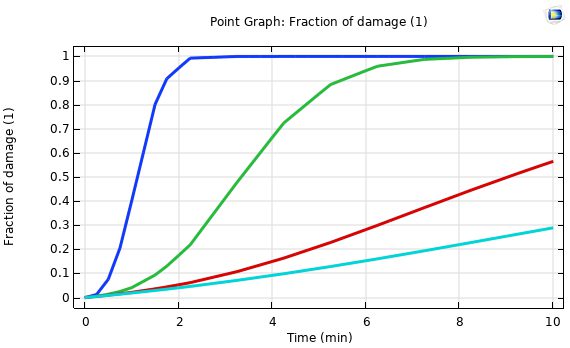
شکل زیر نشان دهنده نمودار کسر بافت آسیب دیده در آنتن هم محور روزنه در فاصله 5 میلیمتر و 10 میلیمتر و 20 میلیمتر از محور آنتن را نشان می دهد. مشاهده می شود که هرچه فاصله تا محور آنتن کمتر باشد درصد بافت آسیب دیده بیشتر است.
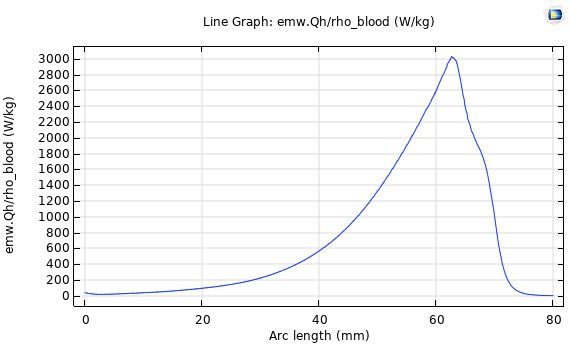
توزیع SAR:
در شکل زیر توزیع SAR در آنتن هم محور روزنه را نشان می دهد. نمودار توزیع SAR در طول محور طولی آنتن به تدریج افزایش می یابد تا به نقطه ماکزیمم خود که مکان قرارگیری روزنه است برسد. سپس توزیع SAR به سرعت کاهش می یابد و در انتهای آنتن به کمترین مقدار خود میرسد. مشاهده می شود که تغییرات مقدار SAR در بافت کبد به عمق نفوذ و آنتن بستگی دارد.