توضیحات
پروژه شبیه سازی خوردگی گالوانیکی آلیاژ منیزیم(AE44)- فولاد نرم در مجاورت با محلول آب شور یا کلریدسیدم(NaCl) در نرم افزار کامسول (COMSOL)
Simulation of Galvanic Corrosion of Magnesium (AE44) – Mild Steel Couples in Brine (NaCl) Medium in COMSOL Software
خوردگی(corrosion):
واژه خوردگی به زوال یا فرسایش سطح یک ماده با فلز در مواجه با یک محیط خورنده اطلاق می شود. اگرچه خوردگی ممکن است ماهیت شیمیایی نیز داشته باشد، اما معمولاً به یک فرآیند اکسیداسیون الکتروشیمیایی اطلاق می شود که در طی آن فلز الکترون های خود را به محیط اطراف منتقل کرده و دستخوش تغییر ظرفیت از صفر به یک مقدار مثبت می شود. محیط های خورنده می توانند مایع یا گاز یا ترکیبی از مایع و جامد باشند. از آنجایی که این محیط ها هادی جریان الکتریسیته هستند، به آنها الکترولیت گفته می شود. واکنش خوردگی به دلیل ماهیت الکتروشیمیایی اش شامل دو نیم واکنش آندی و کاتدی است.
خوردگی گالوانیکی(Galvanic Corrosion):
خوردگی گالوانیک، افزایش خوردگی بین دو یا چند فلز غیر مشابه که در ارتباط الکتریکی با یکدیگر قرار دارند، تعریف می شود. خوردگی گالوانیک یکی از معمول ترین انواع خوردگی است که در دنیای صنعتی ساختارهای مهندسی را تهدید می کند. اثری که کوپل شدن دو فلز یا آلیاژ مختلف دارد، به صورت مستقیم یا از طریق یک مسیر الکتریکی خارجی، افزایش سرعت خوردگی آلیاژ آندی، ماده ای با پتانسیل الکتروشیمیایی منفی تر، و کاهش سرعت خوردگی آلیاژ کاتدی، ماده ای با پتانسیل الکتروشیمیایی مثبت تر، است.
خوردگی گالوانیک وقتی رخ می دهد که یک فلز یا آلیاژ به طور الکتریکی با فلز یا غیرفلز هادی دیگر اتصال الکتریکی داشته باشد. سه جزء اصلی این نوع خوردگی عبارتند از:
- مواد با پتانسیل سطحی متفاوت
- الکترولیت
- اتصال الکتریکی.
یک سیستم فلزی مخلوط در یک الکترولیت، صرفنظر از نزدیکی فلزات با اندازه و پتانسیل نسبی آنها، به طور عملی دچار خوردگی گالوانیک نمی شود. در حین تشکیل زوج گالوانیک، خوردگی فلز با پتانسیل منفی تر (فعال) یا (active) افزایش می یابد و سطح آن به عنوان آند عمل می کند و این در حالی است که خوردگی فلز با پتانسیل مثبت تر(نوبل) یا (noble) کاهش می یابد و سطح آن به عنوان کاتد عمل می کند. وسعت و سرعت خوردگی ناشی از زوج گالوانیک به وسیله موارد زیر تحت تاثیر قرار می گیرد:
- اختلاف پتانسیل بین فلزات یا آلیاژها
- الکترولیت
- رفتار پلاریزاسیون فلزات یا آلیاژها
- فاصله دو فلز از هم
- نسبت سطح آند به کاتد.
اختلاف پتانسیل بین فلزات یا آلیاژهای غیر مشابه، وقتی که آنها به صورت الکتریکی در یک محلول هادی تشکیل زوج دهند، سبب حرکت الکترون بین آنها می شود. جهت حرکت و درنتیجه رفتار گالوانیکی، به اینکه کدام فلز یا آلیاژ فعالتر است، بستگی دارد. بنابراین، فلز یا آلیاژ فعالتر، آند می شود و فلز یا آلیاژ با فعالیت کمتر کاتد می شود. نیروی محرکه برای خوردگی گالوانیک، اختلاف پتانسیل بین فلزات یا آلیاژها است.
ماهیت و خورندگی محیط به میزان زیادی بر شدت خوردگی گالوانیکی تاثیر می گذارد. معمولا فلزی که مقاومت کمتری نسبت به محیط موردنظر دارد، آند می شود. حتی دیده شده که پتانسیل یک زوج گالوانیکی در یک محیط نسبت به محیطی دیگر عکس شده است. اتمسفر و آب دریا جزو محیطی هایی هستند که خوردگی گالوانیکی در آنها بسیار شایع است. محیط های دریایی به واسطه سرعت خوردگی بالا همواره مورد توجه بوده اند. شدت خوردگی گالوانیکی در اتمسفر به نوع و مقدار رطوبت موجود در اتمسفر دارد. خوردگی گالوانیکی معمولاً نزدیک محل اتصال دو فلز شدیدتر است و با دور شدن از این نقطه خوردگی نیز کم می شود. فاصله ای که تحت تاثیر خوردگی قرار می گیرد بستگی به مقاومت محلول دارد. یک فاکتور مهم دیگر در خوردگی گالوانیکی اثر سطح، یا نسبت سطح کاتد آند به می باشد. هرچه دانسیته جریان در منطقه آندی بزرگتر باشد، سرعت خوردگی بیشتر است.
مجموعه گالوانیک فلزات و آلیاژها برای پیش بینی پتانسیل گالوانیکی مفید است. چنین مجموعه ای، چیدمانی از فلزات و آلیاژها است که براساس پتانسیل آنها در یک الکترولیت ویژه طبقه بندی شده اند. مجموعه گالوانیک نشان می دهد که کدام فلز یا آلیاژ در زوج گالوانیک فعالتر است. در برخی حالات، فاصله بین دو فلز یا آلیاژ در مجموعه گالوانیک، شدت اثر خورنده را نشان می دهد. شکل زیر موقعیت نسبی فلزات را در مجموعه گالوانیک برای آب دریا در دمای اتاق را نشان می دهد.
خوردگی گالوانیکی در محیط آب دریا:
در محیط آب دریا نیز، این نوع خوردگی تشدید شده و مواد با پتانسیل منفی تر، دچار انحلال می شوند و الکترون های تولید شده در طی فرآیند انحلال فلز توسط واکنش های کاتدی، که در محیط آب دریا معمولا کاهش اکسیژن محلول در آب است، مصرف می شود. نیروی پیشران خوردگی گالوانیک، اختلاف پتانسیل بین دو یا چند فلز یا آلیاژی است که در یک محیط هادی، با تولید جریان باعث جاری شدن آن بین بخش آندی و کاتدی می شود. گستره خوردگی گالوانیک مابین دو یا چند آلیاژ غیر مشابه به عوامل دیگری چون نسبت سطح موثر آند/ کاتد، مقاومت محلول، دما و پایداری لایه های پسیو، بزرگی اختلاف پتانسیل مابین فلزات غیر مشابه، محتوی اکسیژن محلول و خصوصیات پلاریزاسیونی فلزات و آلیاژهای درگیر در زوج گالوانیک بستگی دارد.
آلیاژ منیزیم:
منیزیم یکی از سبک ترین فلزات است. این عنصر جزو گروه فلزات قلیایی خاکی است. عدد اتمی آن برابر ۱۲ است. چگالی منیزیم 1.74 گرم بر سانتیمترمکعب و وزن اتمی آن برابر 24.3050 گرم بر مول است. این چگالی امکان کاهش وزنی ساختار تا ۳۵ درصد را در مقایسه با مواد پایه فولادی ایجاد می کند. این فلز همچنین هشتمین عنصر فراوان در پوستة زمین، سومین عنصر فراوان و محلول در آب دریا است. رنگ سفید نقره ای دارد. نقطه ذوب آن برابر 650 درجه سانتیگراد و نقطه جوش آن برابر 1091 درجه سانتیگراد است. در کاربردهای مستلزم فلزی با چگالی کم، با آلومینیوم (2.7 گرم بر سانتیمترمکعب) رقابت می کند. آلیاژهای منیزیم قابلیت بازیافت خوبی در کنار قیمت پایین دارند.
در بین آلیاژهای منیزیم، AZ91 به دلیل کاربردهای وسیعش در کامپیوتر و لوازم الکترونیکی ارتباطی بسیار مهم است. به خوبی آشکار است که عملیات سطحی نشاندن پوشش های فلزی می توانند خواص سطحی آلیاژهای منیزیم را بهبود بخشند. به عنوان مثال بخارنشانی منیزیم خلوص بالا بر روی AZ91E و اسپری قوسی یک پوشش آلومینیوم خالص، همانند پرس گرم و آندایزینگ روی AZ31، به شدت مقاومت به خوردگی را در محیط های آب شور ارتقاء داده اند.
منیزیم و آلیاژهای آن دارای خواصی هستند که استفادة گسترده از آنها را محدود می کند. قیمت منیزیم بیشتر از آلومینیوم است. منیزیم به سختی ریخته گری می شود. همچنین منیزیم دارای استحکام نسبتاً پایین و مقاومت به خزش، خستگی و سایش کم هستند. به علاوه منیزیم دارای ساختمان بلوری CPH است که تغییرشکل آن تاحدی محدود است. از طرف دیگر، به علت چگالی خیلی پایین آلیاژهای منیزیم، از آنها در مواردی همچون کاربرد هوافضا و تجهیزات حمل مواد استفاده بهینه می شود.
آلیاژهای منیزیم در طبیعت بسیار فعالند و لایة اکسید تشکیل شده بر روی آنها محافظت کافی در برابر خوردگی فراهم نمی آورد. از روش های قدیمی بهبود این خاصیت، حمام کرومات است که به دلیل سمی بودن امروزه زیاد مقبول نیست. یک روش نویدبخش بر اساس تئوری آلیاژسازی نفوذی است که علاوه بر این که مقاومت به خوردگی را بهبود میبخشد، چسبندگی کافی و خواص مکانیکی بهتری نیز ایجاد می کنند.
پوشش های کروم یکی از محافظ های مهم به شمار آمده و نقش کلیدی در عملیات سطحی مواد فلزی ایفا کرده اند. این پوشش ها معمولاً با بکارگیری مواد شیمیایی بر روی زیرلایه نشانده می شوند، مانند آبکاری الکتروشیمیایی. این در حالی است که پوشش های حاصل در روش PVD نیز به دلیل ساختار فشرده، چسبندگی مناسب و بی ضرر بودن به محیط زیست، جزو پوشش های سبز و محیط دوست مورد توجه برای محافظت آلیاژهای منیزیم بوده اند.
کاربردهای منیزیم و آلیاژهای آن:
منیزیم به خاطر سبکی وزن و استحکام خوب آلیاژهای آن در صنایع اتومبیل سازی، هوافضا، ساخت موشک، هواپیما و نیز در صنایع الکترونیک و ارتباطات به کار برده می شود. از نظر خوردگی یکی از فعالترین فلزات است. درنتیجه به عنوان آندهای قربانی شده در حفاظت کاتدی ، باطری های خشک و همچنین برای استخراج فلزات فعالی نظیر تیتانیوم، زیرکونیوم، اورانیوم استفاده می شود. همچنین منیزیم و آلیاژهای آن به علت زیست تجزیه پذیر و زیست سازگار بودنشان، سبکی بیش از حدشان و داشتن خواص مکانیکی شبیه به استخوان های طبیعی، مواد نویدبخش و خوبی برای کاشت های ارتوپتیک و پیوند استخوان به شمار می روند.
خوردگی گالوانیکی آلیاژهای منیزیم:
مهمترین مزیت و خاصیت منیزیم که موجب گسترش روزافزون آن در صنایع مختلف (پزشکی، هوافضا، الکترونیک، حمل و نقل و اتومبیل) شده است، نسبت استحکام به وزن بالای آن است. مقاومت به خوردگی نسبتاً ضعیف منیزیم به ویژه در محیط های آب نمکی موجب محدودشدن استفاده از آن گردیده است. یکی از مکانیزم های خوردگی، خوردگی گالوانیکی است. خوردگی گالوانیکی به علت اثر پیل دوفلزی ظاهر می شود. الکترودها ممکن است از دو فلز مختلف و یا از یک فلز و یک رسانای الکترون مانند گرافیت یا مغناطیس تشکیل شده باشند. خوردگی گالوانیکی اغلب خوردگی دوفلزی نیز نامیده می شود. در هر حال این مفهوم، معنی جامعتری دارد به طوری که خوردگی حاصل از انواع پیل های گالوانیکی نظیر پیل های غلظتی را در بر می گیرد. در یک پیل خوردگی که دارای دو الکترود فلزی مختلف است، فلز نجیب تر کاتد و فلز کمتر نجیب، آند را تشکیل می دهد. روابط زیر واکنش های آند و کاتد را نشان می دهند. بر این اساس در واکنش آند، اکسایش صورت می گیرد و در واکنش کاتد، کاهش به وجود می آید. تنها، الکترودی که کمتر نجیب(آند) است، مورد حمله قرار می گیرد. به عبارت دیگر معنی خوردگی دوفلزی این است که سرعت خوردگی یک فلز در حضور یک الکترولیت در اثر تماس با یک فلز نجیب تر، بیشتر می شود. زیرا واکنش کاهش روی ماده نجیب تر، ساده تر انجام می گیرد تا روی فلز کمتر نجیب. در ضمن، جریان خوردگی حاصل با ازدیاد سطح، افزایش می یابد. در خوردگی دوفلزی نسبت بین سطح آند و کاتد مهم ترین عامل برای شدت حمله است. قبلا اشاره شد که برای این که خوردگی دوفلزی انجام گیرد، حضور یک الکترولیت لازم است. در ساختارهای فضای باز، فیلم رطوبتی که روی سطح فلز درست می شود، برای خوردگی دوفلزی می تواند کافی باشد. یکی از انواع آلیاژهایی که مستعد خوردگی هستند، آلیاژهای منیزیم است. خوردگی گالوانیکی معمولا به صورت خوردگی موضعی شدید منیزیم(به عنوان آند) در کنار کاتد دیده می شود. فلزات در ترکیب با منیزیم تأثیرات متفاوتی بر رفتار خوردگی آن دارند. میزان خوردگی منیزیم در کوپل گالوانیکی به مقدار اختلاف پتانسیل منیزیم با فلز کوپل شده در جدول الکتروموتیوی بستگی دارد.
برای اجتناب از خوردگی گالوانیکی باید به پیشگیری های زیر توجه داشت:
1-فلزاتی را که در سری الکتروشیمیایی و یا سری گالوانی مشخص تر، کاملاً از یکدیگر فاصله دارند، به هم متصل نکنید. این الزام باید در اتمسفرهای دریایی و یا مکان هایی که سطوح فلزات در معرض رطوبت دائم قرار دارند رعایت شود.
2-در صورت نیاز به فلزات نامشابه، در صورت امکان باید آنها را عایق کاری کرد به طوری که اتصال فلزی ایجاد نشود. می توان از پلاستیک های مقاوم پردوام یا لاستیک به عنوان ماده نارسانا استفاده کرد.
3-سطح تماس و اطراف آن را با رنگ های ضد خوردگی یا قیر بپوشانید. در این صورت، چون مسیر جریان طولانی تر شده و مقاومت بیشتر می شود، این اقدام منجر به کاهش قابل ملاحظه سرعت خوردگی دوفلزی می شود. رنگ کردن نباید به اجسام کمتر نجیب محدود شود زیرا در منافذ موجود در رنگ احتمالا خوردگی موضعی پیش می آید. تنها رنگ کردن فلزات نجیب در بسیاری از موارد، کافی است.
4-طراحی مناسب جهت جلوگیری از حبس شدن آب نمک در محل اتصال منیزیم با فلزات غیرمشابه می تواند مؤثر باشد.
نرم افزار کامسول(COMSOL):
کامسول یک مجموعه کامل شبیه سازی است که معادلات دیفرانسیل سیستم های غیر خطی را توسط مشتق هـای جزئی به روش المان محدود(FEM) در فضاهای یک، دو و سه بعدی حل می کند. همچنین این برنامه یک رابطه گسترده با نرم افزار MATLAB ارائه می دهد و ابزارهای آن در برنامه ریزی پیش پردازش و پس پردازش امکانات خوبی را فراهم می آورد. تا پیش از سال ۲۰۰۵ نام این نرم افزار، FEMLAB بوده است. شرکت کامسول در جولای ۱۹۸۶ در استکهلم سوئد تأسیس شد. بعدها پیشرفت کرد و دفاتری در برزیل، چین، دانمارک، فنلاند، فرانسه، آلمان، هلند، نروژ، هند، ایتالیا، سوئیس، بریتانیا و آمریکا راه اندازی کرد. سوانته لیتمارک و فرهاد سعیدی این شرکت را در سال ۱۹۸۶ تأسیس کردند. اولین نسخه از برنامه COMSOL Multiphysics در سال ۱۹۹۸ منتشـر شد و در آن زمان فقط چنـد مـاژول داشت. بسـتـه نـرم افـزاری برمبنای سیستم عامـل هـای مختلـف نظیـر Linux ،Mac ،Windows و Unix نوشته شده است. به علاوه راحتی کار برای کاربر را مدنظر قرار داده است. این نرم افزار می تواند در حضور چالش هایی نظیر میدان های الکترومغناطیسی، کشش، دینامیک سیالات و دینامیک گاز به خوبی رهگشا باشد. کامسول همچنین فرصتی برای تحلیل و شبیه سازی ساختار نمونه و قالب یک فرمول ریاضیات(در فرم معادلات) و فیزیکی(انتخاب مدل فیزیکی، به عنوان مثال مدل فرایند انتشار) را به کاربر می دهد. بدیهی است در هر مورد سیستم معادلات حل خواهد شد، تفاوت فقط در امکان استفاده از سیستم های فیزیکی و جسمی و واحدها نهفته است. به اصطلاح حالت فیزیکی، می توان از معادلات از پیش تعریـف شـده بـرای اکثر پدیده های انجام گرفته در علوم فناوری استفاده کرد، مانند انواع روشهای انتقال حرارت و برق، تئوری الاستیسیته، نفوذ مولکولی و انتقال جرم و انتشار، انتشار موج، جریان سیال و…
برای حل معادلات COMSOL Multiphysics PDE از روش المان محدود (FEM) استفاده می کند. نرم افزار، آنالیز المان محدود را همراه با Meshing قابل تطبیق و کنترل خطا با استفاده از Solver های عددی مختلف، اجرا می کند. PDEها پایه و اساس قوانین علمی را شکل داده اند و مبنایی برای مدل سازی رنج وسیعی از پدیده های علمی و مهندسی به شمار می روند. بنابراین از COMSOL Multiphysics در محدوده گسترده ای از موارد مختلف می توان استفاده کرد. مثال هایی از این قبیل کاربرد ها در ذیل بیان شده است:
- صوت
- Bioscience
- واکنش های شیمیایی
- نفوذ
- الکترومغناطیس
- دینامیک سیالات
- پیل های سوختی و الکتروشیمی
- زمین شناسی
- انتقال حرارت
- سیستم های میکرو الکترومکانیکی(MEMS)
- نور
- فتونیک
- جریان در محیط های متخلخل
- مکانیک کوانتوم
- فرکانس های رادیویی
- اجسام نیمه هادی
- ساختار مکانیکی
- پدیده های انتقال
- پخش امواج.
بسیاری از کاربردهای عملی شامل کوپل کردن همزمان معادلات PDE چند فیزیکه در سیستم می شوند. برای مثال، مقاومت الکتریکی یک جسم هادی اغلب با دما تغییر می کند و مدل هادی جریان باید شامل اثرات مقاومت حرارتی نیز باشد. در ساختار COMSOL Multiphysics مدل هایی برای محدوده وسیعی از مسائل وجود دارد. برای این منظور، ماژول هایی در نرم افزار طراحی شده است. این ماژول از اصطلاحات فنی و روش های خاصی برای ایجاد یک هماهنگی خاص در جهت ساده سازی تجزیه و تحلیل مدل ها استفاده می نمایند. COMSOL Multiphysics شامل ماژول های زیر می باشد:
- ماژول AC/DC
- ماژول صوت
- ماژول مهندسی شیمی
- ماژول Earth Science
- ماژول انتقال حرارت
- ماژول MEMS
- ماژول RF
- ماژول ساختار مکانیکی.
مراحل شبیه سازی در COMSOL Multiphysics را می توان به شش مرحله کلی تقسیم بندی کرد:
۱- تعریف معادلات حاکم بر فرآیند و انتخاب بعد فضایی سیستم مورد بررسی
۲- تعریف هندسه سیستم در محیط نرم افزاری
۳- تعیین شرایط مرزی.
۴- تعیین خصوصیات فیزیکی و شرایط عملیاتی سیستم و وارد نمودن حدس های اولیه حل.
۵- Meshing و انتخاب Solver لازم و حل سیستم مورد بررسی.
۶- Post processing و نحوه پردازش پاسخ ها
شرح پروژه:
در این پروژه شبیه سازی فرآیند خوردگی زوج گالوانیکی آلیاژ منیزیم(AE44)- فولاد نرم در مجاورت با محلول آب نمک یا کلریدسیدم(NaCl) در نرم افزار کامسول(COMSOL) انجام شده است.
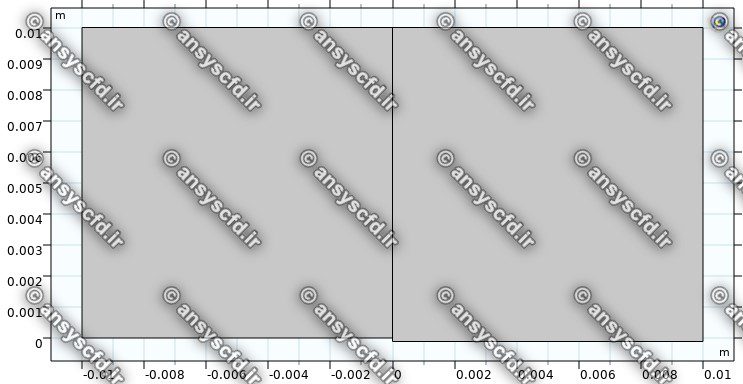
مدلسازی هندسه در نرم افزار کامسول:
شمای مش بندی مدل موردنظر:
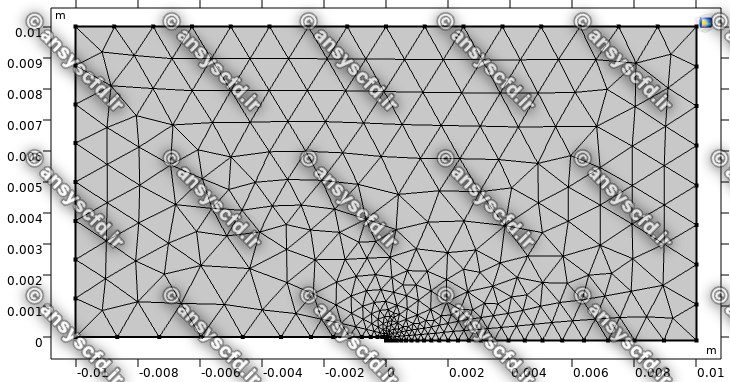
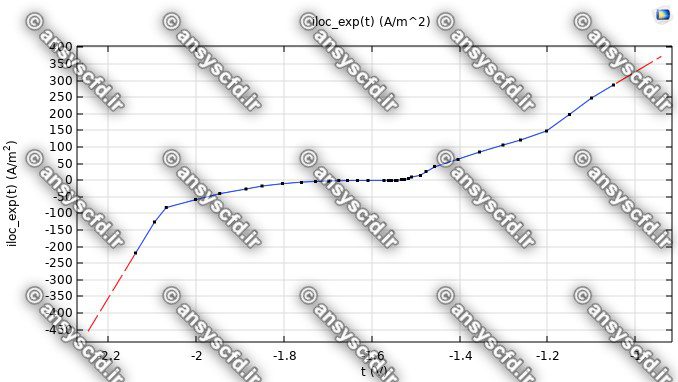
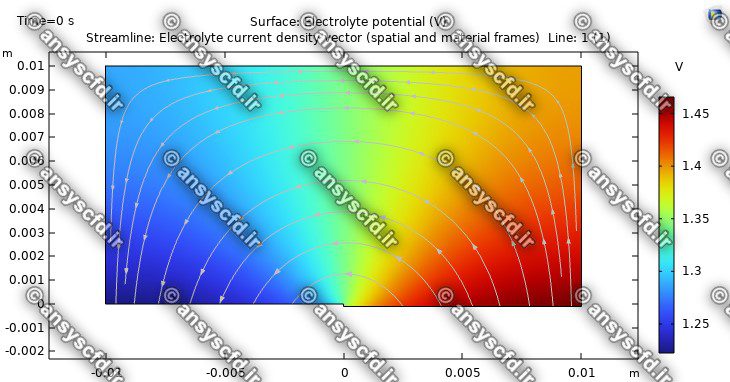
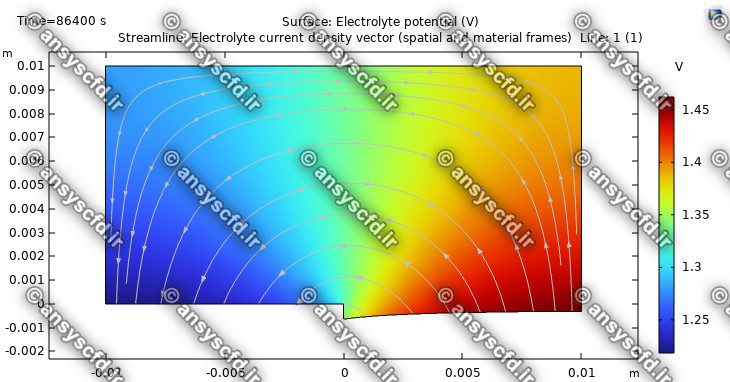
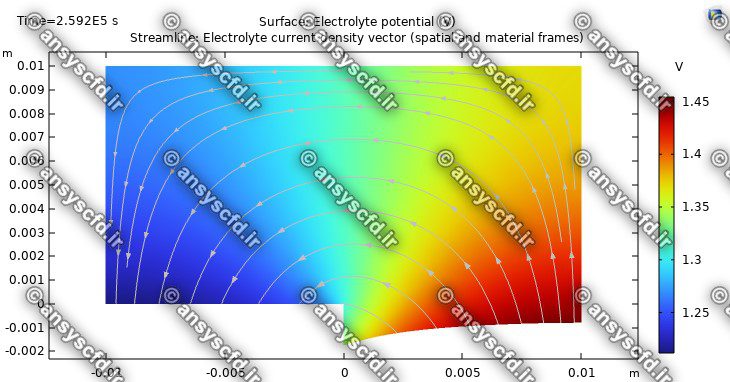
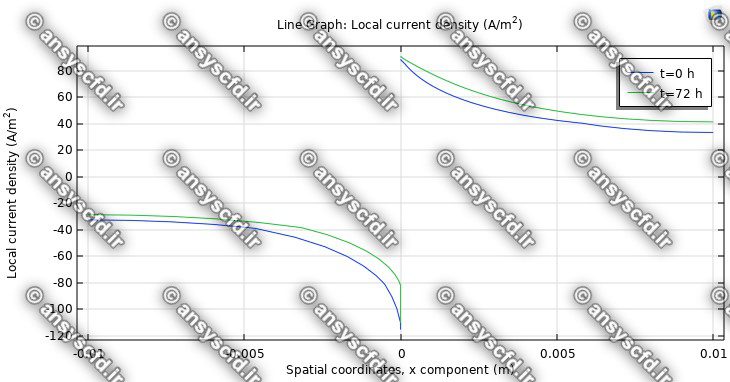
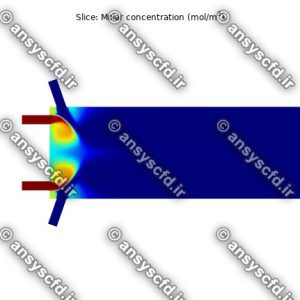
نمونه نتایج شبیه سازی: